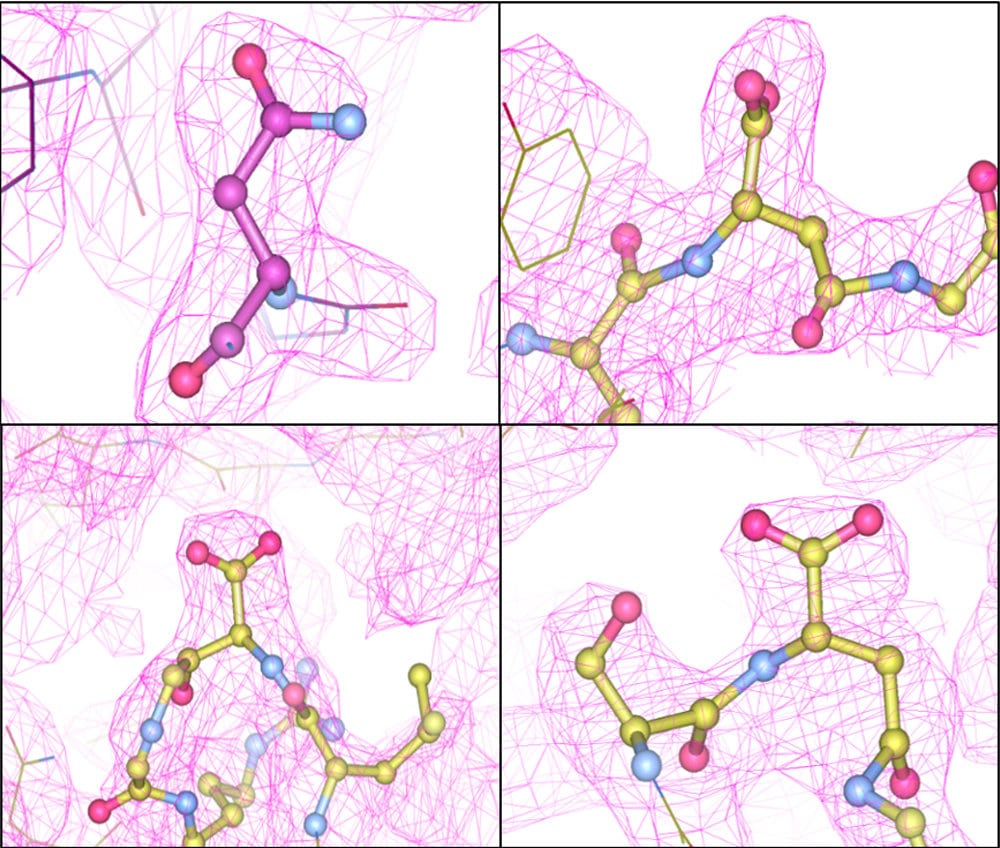
Οι ιικοί φορείς που χρησιμοποιούνται για την παροχή γονιδιακών θεραπειών υποβάλλονται σε αυθόρμητες αλλαγές κατά τη διάρκεια της παρασκευής, οι οποίες επηρεάζουν τη δομή και τη λειτουργία τους, σύμφωνα με μελέτη που δημοσιεύτηκε στη Μοριακή Θεραπεία, σύμφωνα με ερευνητές της Perelman School of Medicine του Πανεπιστημίου της Πενσυλβανίας.
Καθώς οι προσεγγίσεις γονιδιακής θεραπείας καθίστανται πιο συχνές για τη θεραπεία ασθενειών, η διαχείριση της συνοχής της μοριακής σύστασης των σωματιδίων του ιού που παράγουν γονίδια είναι βασικό μέλημα στην κατασκευή σε μεγαλύτερη κλίμακα. Η ομάδα περιγράφει επίσης τρόπους για να καταστήσει τους ιικούς φορείς αποτελεσματικότερους και ασφαλέστερους για τους ασθενείς.
“Αυτή η μελέτη καθόρισε τον τρόπο με τον οποίο ένας ιικός φορέας μπορεί να χάσει τη δραστηριότητά του κατά τη συγκομιδή και τον καθαρισμό στη διαδικασία παρασκευής”, δήλωσε ο καθηγητής της Ιατρικής, James Wilson, MD, Ph.D. “Αυτή η ανακάλυψη μας οδήγησε να αποκαλύψουμε νέους τρόπους για να αποτρέψουμε κάτι τέτοιο, προκειμένου να προσφέρουμε θεραπείες γονιδιακής θεραπείας με ασφαλέστερο και πιο αποτελεσματικό τρόπο”.
Ένας αδενο-σχετιζόμενος ιός (ΑΑν), ένας κοινός φορέας παροχής γονιδιακής θεραπείας, αποτελείται από 60 αλληλοσυνδεόμενες πρωτεΐνες που σχηματίζουν ένα κέλυφος, που ονομάζεται καψίδιο, γύρω από το γονίδιο που χορηγείται. Οι πρωτεΐνες καψιδίου συνεργάζονται για να προσκολληθούν και να εισέλθουν στο κύτταρο, προτού μετακινήσουν το φορτίο τους στη θέση τους μέσα στον πυρήνα του κυττάρου. Οποιαδήποτε αλλαγή σε αυτές τις πρωτεΐνες θα μπορούσε να επηρεάσει την ικανότητα του φορέα να κάνει την παράδοσή του στο σωστό κύτταρο και να εκφράσει μια διορθωτική πρωτεΐνη σε αυτή την περίπλοκη διαδικασία.
Πριν από αυτή τη μελέτη, οι καθαρισμένες εξωτερικές πρωτεΐνες ΑΑν σε δείγματα που προετοιμάστηκαν για προκλινική έρευνα θεωρήθηκαν ταυτόσημα. Ωστόσο, η ομάδα του Penn ανακάλυψε ότι τα AAV είναι πραγματικά διαφορετικά. “Υπάρχει έλλειψη ιστορικού προηγουμένου όσον αφορά τα φυσικά χαρακτηριστικά του καψιδίου του ΑΑΑ κατά τη διάρκεια της διαδικασίας έγκρισης φαρμάκων”, δήλωσε ο πρώτος συγγραφέας Απριλίου R. Giles, Ph.D., ο οποίος πρόσφατα ολοκλήρωσε τη διδακτορική του διατριβή στο εργαστήριο Wilson. “Ως εκ τούτου, επιδιώξαμε να καθορίσουμε τις βιοχημικές ιδιότητες αυτού του μεγάλου, μακρομοριακού συμπλόκου χρησιμοποιώντας τεχνικές που παραδοσιακά χρησιμοποιούνται για τον χαρακτηρισμό άλλων βιολογικών προϊόντων για να κατανοήσουμε καλύτερα αυτά τα εργαλεία παράδοσης γονιδίων”.
Η ομάδα σχεδιάζει τώρα πρωτεΐνες καψιδίου που δεν μεταλλάσσονται αυθόρμητα. Στην πραγματικότητα, διαπίστωσαν ότι η νέα διαδικασία που σταθεροποιεί τις ευαίσθητες περιοχές capsid βελτιώνει επίσης τη λειτουργικότητά τους. «Αυτό ήταν συναρπαστική αφού ξέραμε ότι αν μπορούσαμε με κάποιο τρόπο τη διατήρηση της πρώιμο στάδιο, θα μπορούσε τελικά να παράγουν ΑΑν που απαιτούν τη μισή δόση για να επιτευχθεί το ίδιο γονιδιακή έκφραση,» είπε ο συν-συγγραφέας πρώτη Josh Sims, Ph.D., ανώτερος ερευνητής ερευνητής στο πρόγραμμα Penn Gene Therapy. “Αυτό δεν θα μπορούσε μόνο να μειώσει το κόστος της θεραπείας στο μισό, αλλά θα μπορούσε ενδεχομένως να μειώσει τις παρενέργειες.”
Μελλοντικές μελέτες σε ζωικά μοντέλα σχεδιάζονται για να επιβεβαιώσουν πόσο καλά σωματίδια ΑΑν που κατασκευάζονται για να αντισταθούν σε αυθόρμητες μεταλλάξεις παρέχουν κανονικά γονίδια στα κύτταρα στόχους και πόσο καλά εκφράζουν αυτό το γονίδιο.
Ο Wilson υπογραμμίζει ότι οι απροσδόκητες μεταλλάξεις του AAV γενικά αποτελούν ένα πιθανό ζήτημα ελέγχου της ποιότητας για την αύξηση της παραγωγής φορέων γονιδιακής θεραπείας. “Η ανακάλυψή μας αυτών των λειτουργικά σημαντικών τροποποιήσεων ενισχύει τη σημασία βελτιωμένων αναλυτικών προσδιορισμών για τον χαρακτηρισμό των προϊόντων της AAV”, ανέφερε.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον ΚόσμοΑκολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube