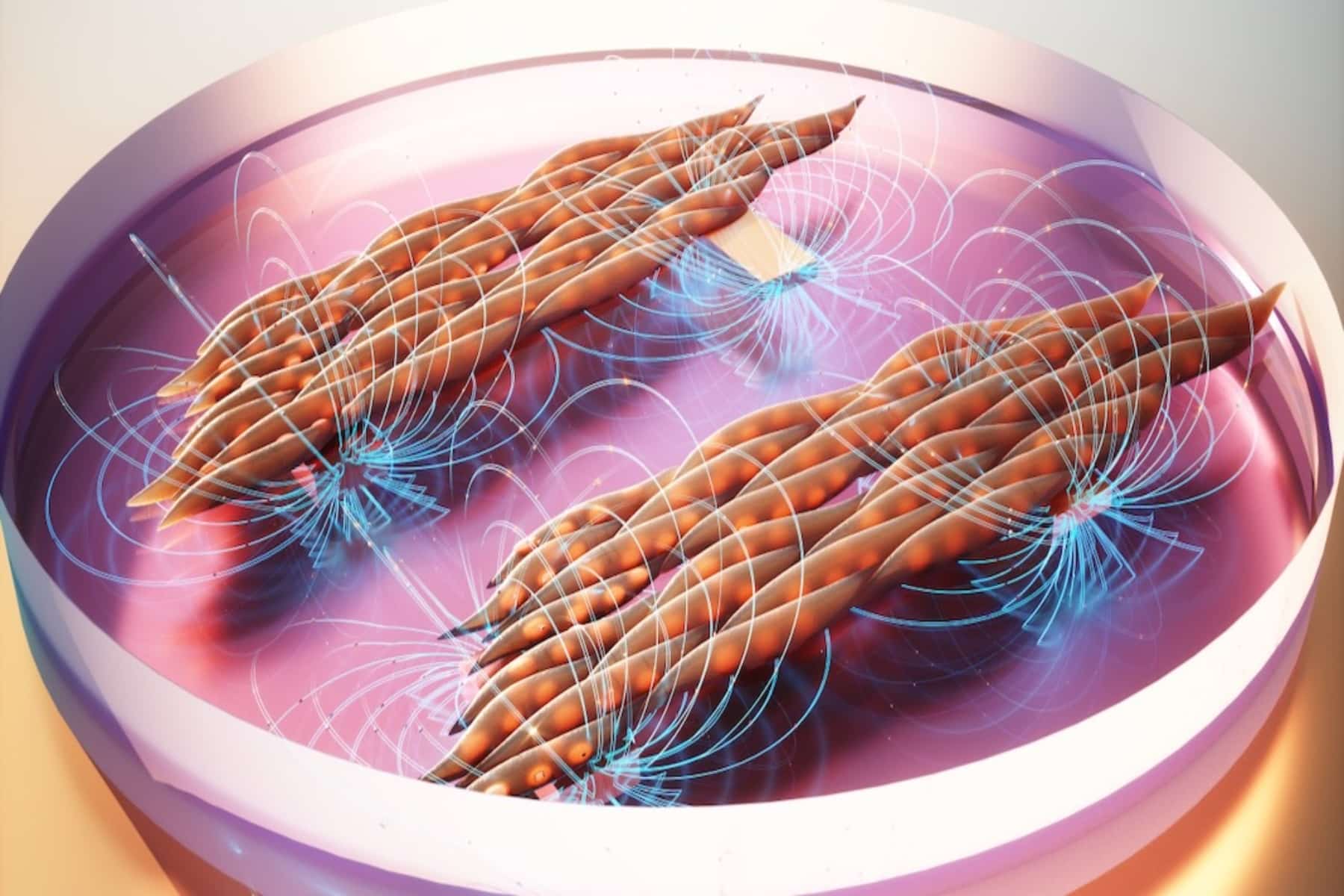
Μυϊκές παθήσεις: Προκαλούμενο από μια γενετική διαταραχή, το LGMD2B εμποδίζει το σώμα να δημιουργήσει μια πλήρως λειτουργική μορφή μιας πρωτεΐνης που ονομάζεται δυσφερλίνη.
Οι βιοϊατρικοί μηχανικοί στο Πανεπιστήμιο Duke ανέπτυξαν μια νέα τεχνική για την καλύτερη κατανόηση και δοκιμή θεραπειών για μια ομάδα εξαιρετικά σπάνιων μυϊκών διαταραχών που ονομάζονται δυσφερλινοπάθεια ή μυϊκές δυστροφίες 2Β της ζώνης των άκρων (LGMD2B). Η προσέγγιση αναπτύσσει πολύπλοκο, λειτουργικό τρισδιάστατο μυϊκό ιστό από βλαστοκύτταρα στο εργαστήριο, δημιουργώντας μια πλατφόρμα που αναπαράγει τα συμπτώματα των ασθενών και τις απαντήσεις στη θεραπεία.
Στην πρώτη τους μελέτη, οι ερευνητές αποκαλύπτουν ορισμένους από τους βιολογικούς μηχανισμούς στους οποίους βασίζεται η χαρακτηριστική απώλεια κινητικότητας που προκαλείται από το LGMD2B. Αποδεικνύουν επίσης ότι ένας συνδυασμός υπαρχουσών θεραπειών μπορεί να είναι σε θέση να ανακουφίσει μερικά από τα χειρότερα συμπτώματα της νόσου. Τα αποτελέσματα εμφανίζονται στο περιοδικό Advanced Science.
Το LGMD2B επηρεάζει μόνο περίπου οκτώ άτομα ανά εκατομμύριο σε όλο τον κόσμο. Σε αντίθεση με την πιο γνωστή και πιο κοινή μυϊκή δυστροφία Duchenne, η ασθένεια επηρεάζει τόσο τους άνδρες όσο και τις γυναίκες, εμφανίζεται αργότερα στη ζωή – στα τέλη της εφηβείας ή στις αρχές της δεκαετίας του ’20 – και σπάνια είναι θανατηφόρος. Ωστόσο, οι ασθενείς με LGMD2B αναπτύσσουν σοβαρή αδυναμία στα πόδια και τους ώμους, απαιτώντας συνήθως να χρησιμοποιούν αναπηρικά καροτσάκια για το υπόλοιπο της ζωής τους.
Προκαλούμενο από μια γενετική διαταραχή, το LGMD2B εμποδίζει το σώμα να δημιουργήσει μια πλήρως λειτουργική μορφή μιας πρωτεΐνης που ονομάζεται δυσφερλίνη. Επί του παρόντος δεν υπάρχουν εγκεκριμένες θεραπείες ή θεραπείες. Μέρος του λόγου αυτής της έλλειψης επιλογών είναι οι πολλές λειτουργίες της δυσφερλίνης, συμπεριλαμβανομένης της σφράγισης οπών στις μυϊκές μεμβράνες, της ρύθμισης των ισορροπιών ασβεστίου που απαιτούνται για τη σύσπαση των μυών και του ελέγχου του κυτταρικού μεταβολισμού. Και για άγνωστους λόγους, οι προσβεβλημένοι μύες αρχικά συσσωρεύουν λίπος μέσα στις ίδιες τις μυϊκές ίνες πριν εκφυλιστούν και τελικά αντικατασταθούν από λιπώδη κύτταρα.
«Αυτό το φαινόμενο είναι πολύ σπάνιο ακόμη και για μυϊκές δυστροφίες», δήλωσε ο Nenad Bursac, καθηγητής βιοϊατρικής μηχανικής στο Duke. «Είναι ένα φλέγον ερώτημα μέσα στην κοινότητα γιατί συμβαίνει αυτό». Μία από τις προκλήσεις που αντιμετωπίζουν οι ερευνητές που προσπαθούν να λύσουν αυτά τα προβλήματα είναι ότι το μοντέλο ποντικιού που χρησιμοποιείται για την προσέγγιση του LGMD2B παρουσιάζει πολύ ήπια συμπτώματα σε σύγκριση με τους ασθενείς. Τα ποντίκια με τη νόσο εξακολουθούν να είναι σε θέση να περπατούν και αυτό δεν εμφανίζεται παρά σχεδόν ένα χρόνο μετά τη διετή διάρκεια ζωής τους, καθιστώντας τις μελέτες της νόσου εξαιρετικά αργές.
Η δυσφερλίνη εκφράζεται σε άλλους τύπους κυττάρων και τα επίπεδα μεταβολικών καυσίμων στο αίμα, όπως η χοληστερόλη, μεταβάλλονται επίσης σε ποντίκια και ασθενείς. Μαζί, αυτό περιπλέκει την έρευνα LGMD2B καθιστώντας δύσκολη την αξιολόγηση των τύπων κυττάρων που ευθύνονται για την ασθένεια και εάν οι μεταβολικές αλλαγές οφείλονται στην απώλεια της ίδιας της δυσφερλίνης ή σε επιδράσεις σε ολόκληρο το σώμα.
Για να ξεπεράσουν αυτές τις προκλήσεις, ο Bursac και ο ερευνητής του, Alastair Khodabukus, στράφηκαν σε μια μηχανική πλατφόρμα μυών που ανέπτυξαν για σχεδόν μια δεκαετία. Το εργαστήριο Bursac ήταν το πρώτο που αναπτύχθηκε συσταλτικός, λειτουργικός ανθρώπινος σκελετικός μυς σε ένα τρυβλίο Petri και έκτοτε βελτιώνει τις διαδικασίες του για να επιτρέψει μελέτες μυϊκής δύναμης, μεταβολισμού και επισκευής. Αυτό το σύστημα τους επέτρεψε να επικεντρώσουν τη μελέτη τους μόνο στις επιδράσεις της δυσφερλίνης στους σκελετικούς μύες χωρίς τις επιπλοκές άλλων τύπων κυττάρων ή αλλαγμένα προφίλ μεταβολιτών του αίματος.
Στη μελέτη, οι ερευνητές ξεκίνησαν με επαγόμενα πολυδύναμα βλαστοκύτταρα (IPSCs) που προέρχονται από ασθενείς που ζουν με LGMD που παρέχεται από το The Jain Foundation, μια φιλανθρωπική οργάνωση που επικεντρώνεται στην εύρεση μιας θεραπείας για το LGMD2B. Χρησιμοποιώντας τις τεχνικές τους για μυϊκή ανάπτυξη, το εργαστήριο ωρίμασε αυτά τα βλαστοκύτταρα σε μυϊκές ίνες και τα έκανε μέσω μιας σειράς δοκιμών κατά τη διάρκεια έξι εβδομάδων.
Όπως οι μύες που βρέθηκαν στους ίδιους τους ασθενείς, οι εκδόσεις που καλλιεργήθηκαν στο εργαστήριο εμφάνιζαν μια μεγάλη ποικιλία θεμάτων. «Συνολικά, το μοντέλο μας επανέλαβε πολλές από τις κλινικές εκδηλώσεις της νόσου και τις παρατηρήσεις που έγιναν σε πραγματικούς ασθενείς, αλλά όλα έγιναν σε ένα πιάτο Petri», είπε ο Bursac. «Καταφέραμε να αποκτήσουμε νέες γνώσεις σχετικά με τις ειδικές για τους μυς πτυχές της νόσου».
Οι ερευνητές ανακάλυψαν ότι η απώλεια μυϊκής δύναμης δεν ήταν αποτέλεσμα ελλείψεων στη μυϊκή δομή ή μέγεθος, αλλά στον χειρισμό του ασβεστίου. Οι μυϊκές συσπάσεις προκαλούνται φυσικά από τις δεξαμενές ασβεστίου στα μυϊκά κύτταρα που απελευθερώνονται και συνδέονται με τις μυϊκές πρωτεΐνες. Οι δοκιμές έδειξαν ότι τα άρρωστα μυϊκά κύτταρα είχαν διαρροές στα αποθέματα ασβεστίου τους, με αποτέλεσμα λιγότερο ασβέστιο να απελευθερωθεί και ασθενέστερες συσπάσεις.
Οι ερευνητές έδειξαν επίσης ότι η έλλειψη δυσφερλίνης προκάλεσε ζημιά στα μυϊκά κύτταρα να μην επισκευαστούν και ότι η αδυναμία καύσης λιπαρών οξέων για παραγωγή ενέργειας ευθύνεται τουλάχιστον εν μέρει για τη συσσώρευση λίπους στις μυϊκές ίνες, η οποία από καιρό προβληματίζει τους ιατρούς. κοινότητα. «Αναπαράγαμε κάτι που είδαμε στους ασθενείς και έδειξε ότι δεν οφείλεται σε περιβαλλοντικούς παράγοντες μέσα στο σώμα, αλλά σε προβλήματα μέσα στον ίδιο τον μυ», είπε ο Khodabukus.

Προχωρώντας προς τα εμπρός, η ομάδα σχεδιάζει να προσθέσει κύτταρα του ανοσοποιητικού και λιπώδη κύτταρα στα πειράματά της για μεγαλύτερη πολυπλοκότητα. Προσπαθούν επίσης να κατανοήσουν περαιτέρω τις διαταραχές στον κυτταρικό μεταβολισμό και να βρουν νέα φάρμακα που αποκαθιστούν πλήρως όλη τη δύναμη, την επιδιόρθωση και το μεταβολικό έλλειμμα.
«Αυτή τη στιγμή, έχουμε ένα βασικό σύστημα μόνο για τους μύες, το οποίο είναι υπέροχο να βλέπουμε τα αποτελέσματα της νόσου μέσα στον ίδιο τον μυ, αλλά αυτό που είναι επίσης σημαντικό είναι η διασταύρωση μεταξύ των κυττάρων του ανοσοποιητικού, των λιποκυττάρων και των μυϊκών κυττάρων», είπε ο Khodabukus. «Χτίζοντας περισσότερο το σύστημά μας, ελπίζουμε ότι θα μπορέσουμε να καταλάβουμε πλήρως τι προκαλεί την απώλεια μυών και την αντικατάστασή του από λίπος σε αυτούς τους ασθενείς».
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον ΚόσμοΑκολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube