Το luspatercept-aamt λαμβάνει θετική γνωμοδότηση από την Επιτροπή Φαρμακευτικών Προϊόντων για Ανθρώπινη Χρήση για τη θεραπεία ενηλίκων με αναιμία στη β-θαλασσαιμία και στα μυελοδυσπλαστικά σύνδρομα.
Η Bristol Myers Squibb (NYSE: BMY) και η Acceleron Pharma Inc. (NASDAQ: XLRN) ανακοίνωσαν πρόσφατα ότι η Επιτροπή Φαρμακευτικών Προϊόντων για Ανθρώπινη Χρήση (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων εξέδωσε θετική γνωμοδότηση, συστήνοντας την έγκριση του luspatercept-aamt για τη θεραπεία:
- ενηλίκων ασθενών με εξαρτώμενη από μεταγγίσεις αναιμία λόγω μυελοδυσπλαστικών συνδρόμων (ΜΔΣ) με πολύ χαμηλό, χαμηλό και ενδιάμεσο κίνδυνο με δακτυλιοειδείς σιδηροβλάστες, οι οποίοι είχαν μη ικανοποιητική απόκριση ή είναι ακατάλληλοι για θεραπεία που βασίζεται στην ερυθροποιητίνη
- ενηλίκων ασθενών με εξαρτώμενη από μεταγγίσεις αναιμία που σχετίζεται με βήτα θαλασσαιμία
Η σύσταση της Επιτροπής Φαρμακευτικών Προϊόντων για Ανθρώπινη χρήση (CHMP) θα αξιολογηθεί από την Ευρωπαϊκή Επιτροπή, η οποία είναι αρμόδια για την έγκριση φαρμάκων για την Ευρωπαϊκή Ένωση. Εάν εγκριθεί, το luspatercept-aamt θα αποτελέσει τον πρώτο εγκεκριμένο παράγοντα ωρίμανσης ερυθρών στην Ευρωπαϊκή Ένωση, αντιπροσωπεύοντας μια νέα κατηγορία θεραπείας για τους επιλέξιμους ασθενείς που πληρούν τις προϋποθέσεις. Τα αποτελέσματα ασφάλειας και αποτελεσματικότητας που περιλαμβάνονται στην αίτηση για έγκριση προέρχονται από τις πιλοτικές μελέτες Φάσης 3 MEDALIST και BELIEVE, που αξιολόγησαν την ικανότητα του luspatercept-aamt να αντιμετωπίζει αποτελεσματικά την αναιμία που σχετίζεται με μυελοδυσπλαστικά σύνδρομα (ΜΔΣ) και β-θαλασσαιμία, αντίστοιχα.
«Οι ασθενείς με μυελοδυσπλαστικά σύνδρομα που εμφανίζουν αναιμία διαθέτουν περιορισμένες θεραπευτικές επιλογές, ενώ έχει καταδειχθεί ότι ορισμένοι δεν ανταποκρίνονται στις διαθέσιμες θεραπείες με ερυθροποιητίνη», δήλωσε ο Uwe Platzbecker, M.D., Επικεφαλής της Κλινικής και Πολυκλινικής για την Αιματολογία και την Κυτταρική Θεραπεία στο Πανεπιστημιακό Νοσοκομείο Leipzig και κύριος ερευνητής της μελέτης MEDALIST. «Εάν εγκριθεί, η εισαγωγή μίας νέας κατηγορίας θεραπείας με το luspatercept-aamt πιθανόν να προφέρει μια πολλά υποσχόμενη επιλογή, η οποία θα συμβάλει στην ανακούφιση των ασθενών από το φορτίο των τακτικών μεταγγίσεων για τη διαχείριση της νόσου τους».
«Η σημερινή θετική γνωμοδότηση της Επιτροπής Φαρμακευτικών Προϊόντων για Ανθρώπινη χρήση (CHMP) για το luspatercept-aamt αποτελεί σημαντικό ορόσημο για τους ενήλικους ασθενείς με β-θαλασσαιμία στην ΕΕ, οι οποίοι διαθέτουν περιορισμένες θεραπευτικές επιλογές για την αντιμετώπιση της αναιμίας, μιας σοβαρής συνέπειας της νόσου», δήλωσε η Maria Domenica Cappellini, M.D., Καθηγήτρια Ιατρικής, Πανεπιστήμιο του Μιλάνου ̶ Fondazione IRCCS Ca Granda, και κύρια ερευνήτρια της μελέτης BELIEVE. «Το luspatercept-aamt έχει τη δυνατότητα να μειώσει σημαντικά τον αριθμό των μεταγγίσεων ερυθρών αιμοσφαιρίων που χρειάζονται οι ασθενείς».
«Αυτή η απόφαση της Επιτροπής Φαρμακευτικών Προϊόντων για Ανθρώπινη χρήση (CHMP) αποτελεί σημαντικό βήμα ώστε αυτή η πρώτη στην κατηγορία της θεραπεία να αποτελέσει μία επιλογή για τους ασθενείς με αναιμία λόγω β-θαλασσαιμίας ή μυελοδυσπλαστικών συνδρόμων», δήλωσε η Diane McDowell, M.D., αντιπρόεδρος του Τμήματος Παγκόσμιων Ιατρικών Υποθέσεων στον τομέα της Αιματολογίας της Bristol Myers Squibb. «Εμείς, και οι συνεργάτες μας στην Acceleron, προσβλέπουμε στην ευκαιρία να καταστήσουμε διαθέσιμη αυτή τη θεραπευτική επιλογή στην ΕΕ και είμαστε ιδιαίτερα ευγνώμονες στους ασθενείς, τις οικογένειες και τα άτομα που συνεχίζουν να μας βοηθούν να διενεργούμε σημαντική έρευνα σε ένα φάσμα σοβαρών νόσων».
Σχετικά με τη μελέτη MEDALIST
Η μελέτη MEDALIST είναι μία τυχαιοποιημένη, διπλά τυφλή, ελεγχόμενη με εικονικό φάρμακο, πολυκεντρική μελέτη Φάσης 3 που αξιολογεί την ασφάλεια και την αποτελεσματικότητα του luspatercept-aamt σε συνδυασμό με βέλτιστη υποστηρικτική αγωγή (BSC) έναντι εικονικού φαρμάκου και βέλτιστης υποστηρικτικής αγωγής (BSC) σε ενήλικους ασθενείς με μυελοδυσπλαστικά σύνδρομα (ΜΔΣ) πολύ χαμηλού, χαμηλού ή ενδιάμεσου κινδύνου κατά IPSS-R (Αναθεωρημένο Διεθνές Σύστημα Προγνωστικής Βαθμολόγησης) και χωρίς την γενετική ανωμαλία απώλειας του μακρού σκέλους του χρωμοσώματος 5 (del 5q). Όλοι οι ασθενείς ήταν εξαρτώμενοι από μετάγγιση ερυθρών αιμοσφαιρίων (RBC) και εμφάνιζαν ανθεκτικότητα ή δυσανεξία σε προηγούμενη θεραπεία με παράγοντα διέγερσης της ερυθροποίησης (ESA) ή δεν είχαν λάβει προηγούμενη θεραπεία με παράγοντα διέγερσης της ερυθροποίησης (ESA) και δεν είχαν πιθανότητες να ανταποκριθούν λόγω επιπέδων ενδογενούς ερυθροποιητίνης στον ορό ≥ 200 U/L, ενώ επίσης δεν είχαν λάβει προηγούμενη θεραπεία με ανοσοτροποποιητικούς παράγοντες. Τα αποτελέσματα της μελέτης MEDALIST παρουσιάστηκαν για πρώτη φορά στη διάρκεια της ολομέλειας του 60ού Ετήσιου Συνέδριου της Αμερικανικής Αιματολογικής Εταιρείας (ASH) το 2018 και συμπεριλήφθηκαν στα σημαντικότερα επιτεύγματα του συνεδρίου (Best of ASH). Το ιατρικό περιοδικό New England Journal of Medicine δημοσίευσε τα αποτελέσματα της μελέτης MEDALIST τον Ιανουάριο του 2020.
Σχετικά με τα μυελοδυσπλαστικά σύνδρομα
Τα μυελοδυσπλαστικά σύνδρομα (ΜΔΣ) αποτελούν μια ομάδα στενά συνδεόμενων αιματολογικών κακοηθειών που χαρακτηρίζονται από την αναποτελεσματική παραγωγή υγιών ερυθρών αιμοσφαιρίων, λευκών αιμοσφαιρίων και αιμοπεταλίων, που είναι δυνατό να οδηγήσει σε αναιμία και συχνές ή σοβαρές λοιμώξεις. Τα άτομα με ΜΔΣ που εμφανίζουν αναιμία συνήθως απαιτούν τακτικές μεταγγίσεις αίματος για την αύξηση του αριθμού των υγιών κυκλοφορούντων ερυθρών αιμοσφαιρίων. Οι τακτικές μεταγγίσεις σχετίζονται με αυξημένο κίνδυνο υπερφόρτωσης σιδήρου, αντιδράσεων στη μετάγγιση και λοιμώξεων. Υπάρχουν περίπου 50.000 ασθενείς με ΜΔΣ στις 5 μεγαλύτερες χώρες της ΕΕ.
Σχετικά με τη μελέτη BELIEVE
Η μελέτη BELIEVE είναι μια τυχαιοποιημένη, διπλά τυφλή, ελεγχόμενη με εικονικό φάρμακο πολυκεντρική μελέτη Φάσης 3 που συγκρίνει το luspatercept-aamt, σε συνδυασμό με βέλτιστη υποστηρικτική αγωγή (BSC) έναντι εικονικού φαρμάκου και βέλτιστης υποστηρικτικής αγωγής (BSC) σε ενήλικους ασθενείς που έχουν ανάγκη τακτικές μεταγγίσεις ερυθρών αιμοσφαιρίων λόγω β-θαλασσαιμίας (6-20 μονάδες ερυθρών αιμοσφαιρίων ανά 24 εβδομάδες, χωρίς το διάστημα κατά το οποίο δεν πραγματοποιείται μετάγγιση να υπερβαίνει τις 35 ημέρες). Τα αποτελέσματα της μελέτης BELIEVE παρουσιάστηκαν για πρώτη φορά στο 60ό Ετήσιο Συνέδριο της Αμερικανικής Αιματολογικής Εταιρείας (ASH) το 2018 και συμπεριλήφθηκαν στα σημαντικότερα επιτεύγματα του συνεδρίου (Best of ASH). Το ιατρικό περιοδικό New England Journal of Medicine δημοσίευσε τα αποτελέσματα της μελέτης BELIEVE το Μάρτιο του 2020.
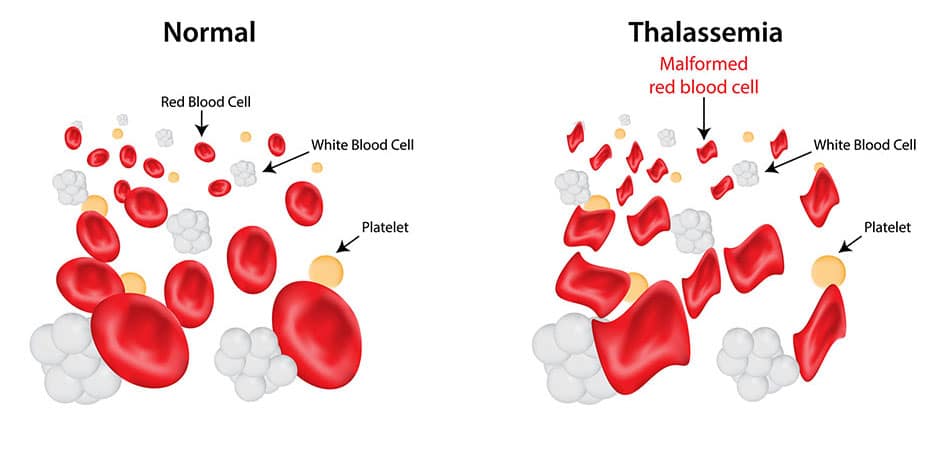
Σχετικά με τη β-θαλασσαιμία
Η β-θαλασσαιμία είναι μία κληρονομική αιματολογική διαταραχή που οφείλεται σε μια γενετική ανωμαλία της αιμοσφαιρίνης. Η νόσος σχετίζεται με την αναποτελεσματική ερυθροποίηση, η οποία οδηγεί στην παραγωγή μειωμένων και λιγότερο υγιών ερυθρών αιμοσφαιρίων, καταλήγοντας συνήθως στην εμφάνιση σοβαρής αναιμίας ̶ μία πάθηση που ενδέχεται να είναι εξουθενωτική και να οδηγεί σε σοβαρότερες επιπλοκές για τους ασθενείς ̶ καθώς και σε άλλα σοβαρά προβλήματα υγείας. Οι θεραπευτικές επιλογές για την αναιμία που σχετίζεται με τη β-θαλασσαιμία είναι περιορισμένες, καθώς κατά κύριο λόγο περιλαμβάνουν τις τακτικές μεταγγίσεις ερυθρών αιμοσφαιρίων (RBC) οι οποίες είναι δυνατό να συμβάλλουν στην υπερφόρτωση σιδήρου. Με τη σειρά της, η υπερφόρτωση σιδήρου μπορεί να προκαλέσει σοβαρές επιπλοκές, όπως η βλάβη οργάνων. Στις Ηνωμένες Πολιτείες, τη Γερμανία, τη Γαλλία, την Ιταλία, την Ισπανία και το Ηνωμένο Βασίλειο, υπάρχουν περίπου 17.000 ασθενείς με β-θαλασσαιμία.
Σχετικά με το luspatercept–aamt
Το luspatercept-aamt, ένας πρώτος στην κατηγορία του (first-in-class) παράγοντας ωρίμανσης ερυθρών (erythroid maturation agent – EMA), προάγει την ωρίμανση τελικής φάσης των ερυθρών αιμοσφαιρίων σε ζωικά μοντέλα. Η Bristol Myers Squibb και η Acceleron αναπτύσσουν από κοινού το luspatercept-aamt στο πλαίσιο μιας παγκόσμιας συνεργασίας. Επί του παρόντος, το luspatercept-aamt είναι εγκεκριμένο στις ΗΠΑ για τη θεραπεία της:
- αναιμίας σε ενήλικους ασθενείς με β-θαλασσαιμία οι οποίοι έχουν ανάγκη τακτικές μεταγγίσεις ερυθρών αιμοσφαιρίων (RBC), και
- αναιμίας που δεν ανταποκρίνεται σε έναν παράγοντα διέγερσης της ερυθροποίησης (ESA) και απαιτεί 2 ή περισσότερες μονάδες ερυθρών αιμοσφαιρίων σε διάστημα 8 εβδομάδων σε ενήλικους ασθενείς με πολύ χαμηλού έως ενδιάμεσου κινδύνου μυελοδυσπλαστικά σύνδρομα (ΜΔΣ) οι οποίοι έχουν δακτυλιοειδείς σιδηροβλάστες ή ασθενείς με μυελοδυσπλαστικό/μυελοϋπερπλαστικό νεόπλασμα με δακτυλιοειδείς σιδηροβλάστες και θρομβοκυττάρωση.
Το luspatercept-aamt δεν ενδείκνυται για χρήση ως υποκατάστατο των μεταγγίσεων ερυθρών αιμοσφαιρίων (RBC) σε ασθενείς που έχουν ανάγκη από άμεση διόρθωση της αναιμίας.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον ΚόσμοΑκολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube