Το New England Journal of Medicine δημοσιεύει 2 μελέτες Φάσης 3 του Bimekizumab στη Μέτρια ως Σοβαρή Ψωρίαση κατά Πλάκας
- Στις 23 Απριλίου 2021, δημοσιεύθηκαν ταυτόχρονα 2 άρθρα με τα πλήρη αποτελέσματα από τις μελέτες BE RADIANT και BE SURE, που συνέκριναν την ασφάλεια και αποτελεσματικότητα του bimekizumab με το secukinumab και το adalimumab αντίστοιχα.
- Τα αποτελέσματα της BE RADIANT μοιράστηκαν επίσης ως προφορικές παρουσιάσεις στο AAD VMX 2021
- Στην BE RADIANT, το bimekizumab ήταν ανώτερο του secukinumab στην επίτευξη πλήρως καθαρού δέρματος (PASI 100) τη 16η εβδομάδα, κύριο καταληκτικό στοιχείο της μελέτης , και τη 48η εβδομάδα, δευτερεύον καταληκτικό σημείο
- Το Bimekizumab είναι υπό αξιολόγηση από τον Αμερικανικό Οργανισμό Τροφίμων και Φαρμάκων (FDA) και τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA) για τη θεραπεία ενήλικων ασθενών με μέτρια ως σοβαρή Ψωρίαση κατά πλάκας
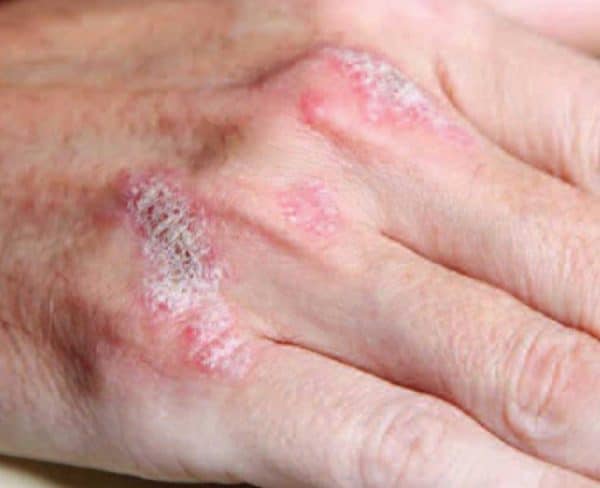
Βρυξέλλες, Βέλγιο – 23 Απριλίου, 2021– H UCB, μία βιοφαρμακευτική εταιρεία με παρουσία σε όλο τον κόσμο ανακοίνωσε ότι το The New England Journal of Medicine δημοσίευσε τα αποτελέσματα της BE RADIANT και BE SURE, 2 μελετών φάσης 3 που αξιολόγησαν το προφίλ ασφάλειας και αποτελεσματικότητας του bimekizumab, ενός υπό έρευνα αναστολέα IL-17A και IL-17F, στη θεραπεία ασθενών με μέτρια ως σοβαρή Ψωρίαση κατά Πλάκας .[i],[ii] Τα αποτελέσματα της μελέτης φάσης 3β BE RADIANT ανακοινώθηκαν προφορικά στο American Academy of Dermatology Virtual meeting Experience 2021 .[iii] H BE RADIANT είναι η πρώτη μελέτη φάσης 3 που συνέκρινε την αποτελεσματικότητα και την ασφάλεια της διπλής αναστολής των IL-17A και IL-17F, έναντι της αναστολής της IL-17A μόνο .1
“Η δημοσίευση των δεδομένων από τις μελέτες BE RADIANT και BE SURE στο The New England Journal of Medicine υπογραμμίζει τη σημασία των μελετών αυτών για την ιατρική κοινότητα και ακολουθεί τη δημοσίευση τους στοThe Lancet, είπε ο Emmanuel Caeymaex, Εκτελεστικός Αντιπρόεδρος Ανοσολογίας και επικεφαλής ΗΠΑ, UCB.
“Τα αποτελέσματα που ανακοινώθηκαν σήμερα, αντικατοπτρίζουν τα υψηλά ποσοστά πλήρους κάθαρσης του δέρματος, PASI 100 τη 16η εβδομάδα, την ταχεία απόκριση μετά από μία δόση και τη διατηρησιμότητα των αποτελεσμάτων έως και ένα χρόνο, τα οποία είχαν παρατηρηθεί και στις προηγούμενες μελέτες του bimekizumab .”
Η ασφάλεια και η αποτελεσματικότητα του bimekizumab δεν έχουν τεκμηριωθεί και δεν έχει εγκριθεί από καμία ρυθμιστική αρχή παγκοσμίως.
ΑΠΟΤΕΛΕΣΜΑΤΑ BE RADIANT Η μελέτη φάσης 3β BE RADIANT, συνέκρινε την ασφάλεια και αποτελεσματικότητα της μπιμεκιζουμάμπης σε σχέση με τη σεκουκινουμάμπη, σε ενήλικες ασθενείς με μέτρια ώς σοβαρή Ψωρίαση κατά πλάκας.1 Η μελέτη πέτυχε το κύριο καταληκτικό της σημείο, με σημαντικά περισσότερους ασθενείς που έλαβαν μπιμεκιζουμάμπη, να επιτυγχάνουν πλήρη κάθαρση δέρματος, όπως αυτή μετρήθηκε με τον Δείκτη Έκτασης και Βαρύτητας της Ψωρίασης (PASI 100) τη 16η εβδομάδα σε σύγκριση με τους ασθενείς που έλβαν σεκουκινουμάμπη (61,7% έναντι 48,9% αντιστοίχως, p<0,001). 1
Η μελέτη πέτυχε επίσης όλα τα δευτερεύοντα καταληκτικά της σημεία.1 Τα ανώτερα επίπεδα επίτευξης καθαρού δέρματος που παρατηρήθηκαν τη 16η εβδομάδα, συνεχίστηκαν μέχρι την εβδομάδα 48, με το 67.0% των ασθενών πού έλαβαν bimekizumab να επιτυγχάνουν PASI 100, συγκριτικά με το 46,02% των ασθενών που έλαβαν secukinumab (p<0.001). 1 Tην 48η εβδομάδα, τόσο οι ασθενείς που έλαβαν bimekizumab κάθε 4 εβδομάδες (Q4W), όσο και αυτοί που το έλαβαν κάθε 8 εβδομάδες (Q8W), επέδειξαν υψηλότερα ποσοστά πλήρους κάθαρσης του δέρματος (PASI 100), συγκριτικά με το secukinumab (p<0.001).1 Επιπρόσθετα, την 4η εβδομάδα, σημαντικά περισσότεροι ασθενείς που έλαβαν bimekizumab πέτυχαν PASI 75 συγκριτικά με τους ασθενείς που έλαβαν secukinumab (71.0%έναντι 47.3%, αντίστοιχα; p<0.001).1
“Στην BE RADIANT, οι ασθενείς που έλαβαν bimekizumab πέτυχαν ανώτερα ποσοστά πλήρους κάθαρσης του δέρματος, το κύριο καταληκτικό σημείο της μελέτης, τα οποία διατηρήθηκαν μέχρι και τη 48η εβδομάδα. Την 4η εβδομάδα, παρατηρήθηκε επίσης γρηγορότερη έναρξη δράσης στους ασθενείς που έλαβαν bimekizumab συγκριτικά με αυτούς που έλαβαν secukinumab. Τα δεδομένα της μελέτης υποστηρίζουν την αξία της αναστολής της IL-17F επιπρόσθετα με την IL17A στη θεραπεία των ασθενών με μέτρια ως σοβαρή Ψωρίαση κατά Πλάκας .” είπε ο Κ. Kristian Reich, M.D., Ph.D., Translational Research in Inflammatory Skin Diseases, Institute for Health Services Research in Dermatology and Nursing, University Medical Center Hamburg-Eppendorf, Germany.
Καθ’ όλη τη διάρκεια της μελέτης, το πιο κοινό ανεπιθύμητο σύμβαμα που προέκυψε από τη θεραπεία (TEAEs) με bimekizumab ήταν η λοίμωξη ανώτερου αναπνευστικού* (38.9%), στοματική λοίμωξη από candida (19.3%) και λοιμώξεις ουροποιητικού (6.7%).1 Τα περιστατικά στοματικής καντιντίασης ήταν κυρίως ήπιας ή μέτριας βαρύτητας και κανένα δεν οδήγησε σε διακοπή της θεραπείας.1 Σε διάστημα 48 εβδομάδων η επίπτωση των σχετιζόμενων με τη θεραπεία ανεπιθύμητων συμβάντων ήταν 5,9% για το bimekizumab και 5,7% με το secukinumab .1
ΑΠΟΤΕΛΕΣΜΑΤΑ BE SURE
Η μελέτη Φάσης 3 BE SURE συνέκρινε την αποτελεσματικότητα και ασφάλεια του bimekizumab συγκριτικά με το adalimumab σε ενήλικες ασθενείς με μέτρια ως σοβαρή Ψωρίαση κατά πλάκας.2 Τα αποτελέσματα της μελέτης BE SURE είχαν προηγουμένως αναφερθεί στο Συνέδριο 2020 της Ευρωπαϊκής Ακαδημίας Δερματολογίας και Αφροδισιολογίας (EADV)..[iv]
Η BE SURE πέτυχε τα κύρια καταληκτικά σημεία της, αποδεικνύοντας ότι οι ασθενείς που έλαβαν bimekizumab πέτυχαν ανώτερα επίπεδα κάθαρσης του δέρματος, την 16η εβδομάδα, σε σύγκριση με εκείνους που έλαβαν adalimumab, όπως μετρήθηκε από την επίτευξη του PASI 90 και την ανταπόκριση για «καθαρό» ή «σχεδόν καθαρό» δέρμα (IGA 0/1); p <0,001 και για τις δύο συγκρίσεις.2 Τα αποτελέσματα αυτά υποστηρίχθηκαν περεταίρω, καθώς η μελέτη πέτυχε και όλα τα δευτερεύοντα καταληκτικά της σημεία .2 Το προφίλ ασφάλειας του bimekizumab ήταν συνεπές με τα αποτελέσματα των προηγούμενων κλινικών μελετών και δεν εντοπίστηκαν νέα σήματα ασφάλειας .[v],[vi],[vii],[viii]
Τον Σεπτέμβριο του 2020, η UCB ανακοίνωσε ότι ο FDA και ο EMA είχαν αποδεχτεί την Αίτηση Βιολογικής Άδειας της Εταιρείας (BLA) και την Αίτηση Άδειας Κυκλοφορίας (MAA), αντίστοιχα, για το bimekizumab για τη θεραπεία της μέτριας έως σοβαρής Ψωρίασης κατά Πλάκας σε ενήλικες ασθενείς. Η UCB αποσκοπεί να παρέχει πρόσβαση στο bimekizumab σε ασθενείς σε όλο τον κόσμο, και για αυτόν τον σκοπό έχουν υποβληθεί επιπρόσθετες αιτήσεις έγκρισης που βρίσκονται σε εξέλιξη.
*Οι λοιμώξεις του ανώτερου αναπνευστικού συστήματος περιλαμβάνουν λαρυγγίτιδα, ρινοφαρυγγίτιδα, φαρυγγικό απόστημα, φαρυγγίτιδα, ρινίτιδα, ιγμορίτιδα, αμυγδαλίτιδα και λοίμωξη του ανώτερου αναπνευστικού συστήματος.
Σχετικά με το Bimekizumab
Το bimekizumab είναι ένα υπό διερεύνηση ανθρωποποιημένο μονοκλωνικό αντίσωμα IgG1 που αναστέλλει επιλεκτικά τις IL-17A και IL-17F, δύο βασικές κυτταροκίνες που καθοδηγούν τις φλεγμονώδεις διαδικασίες.[ix] Η IL-17F έχει επικαλυπτόμενη βιολογική δράση με την IL-17Α και παρουσιάζει προ-φλεγμονώδεις δράσεις ανεξάρτητα από την IL-17A.[x],[xi],[xii],[xiii],[xiv] Η επιλεκτική αναστολή της IL- 17F σε συνδυασμό με την IL- 17A καταστέλλει τη φλεγμονή σε μεγαλύτερο βαθμό από την αναστολή της IL- 17A μόνο.13,14
Η ασφάλεια και η αποτελεσματικότητα του bimekizumab αξιολογούνται σε πολλαπλά νοσήματα ως μέρος ενός εκτεταμένου κλινικού προγράμματος.
Σχετικά με την Ψωρίαση
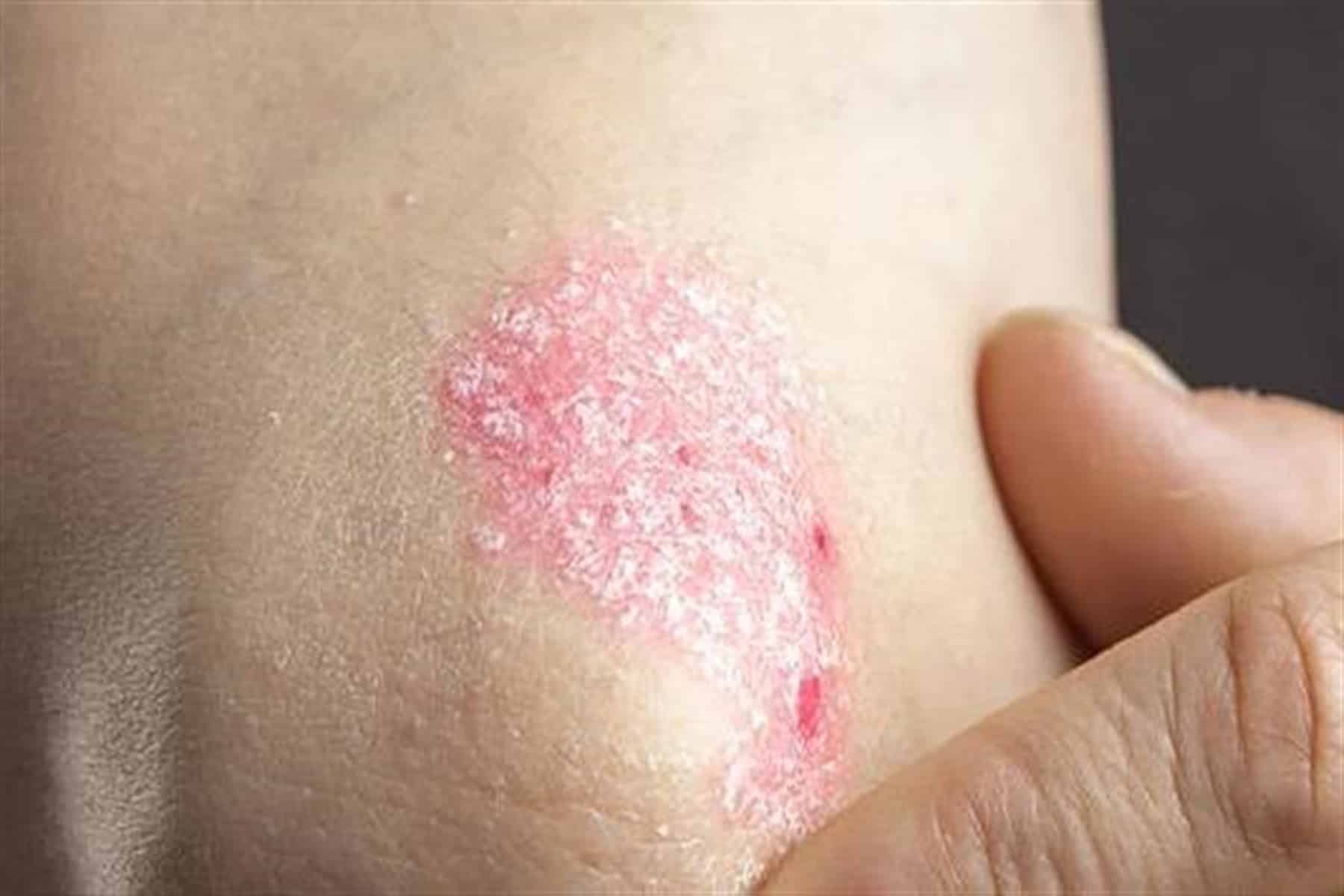
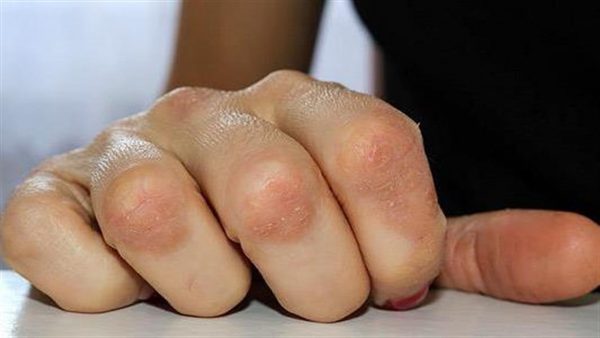
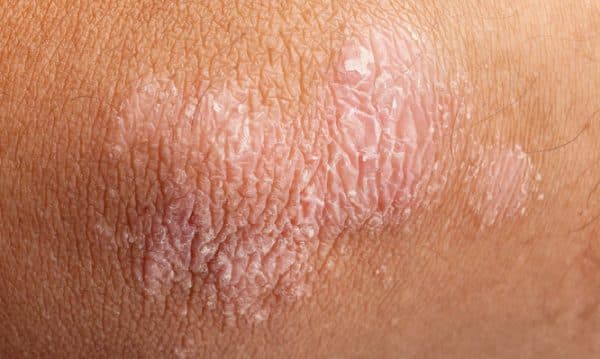
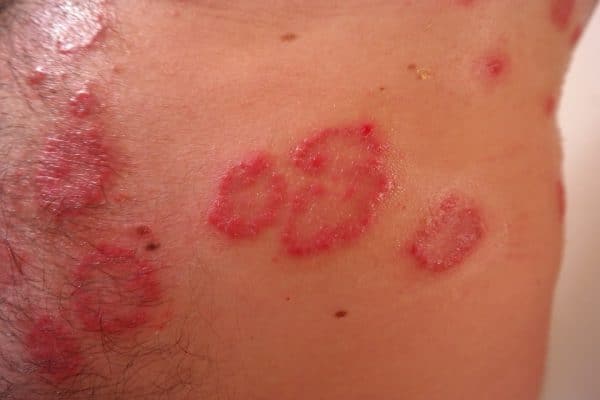
Η ψωρίαση είναι μία συχνά εμφανιζόμενη, χρόνια φλεγμονώδης νόσος που προσβάλει κυρίως το δέρμα. Η δερματική αυτή πάθηση προσβάλλει άνδρες και γυναίκες κάθε ηλικίας και εθνότητας. Τα σημεία και τα συμπτώματα της ψωρίασης μπορεί να ποικίλουν αλλά ενδέχεται να περιλαμβάνουν ερυθρές κηλίδες στο δέρμα που καλύπτονται με αργυρόχρωμα λέπια, ξηρό, σκασμένο δέρμα που μπορεί να αιμορραγεί και πάχυνση των νυχιών, με εντυπώματα ή αυλακώσεις.[xv]
Η ψωρίαση προσβάλλει σχεδόν το 3% του πληθυσμού, ή περίπου 125 εκατομμύρια ανθρώπους παγκοσμίως.[xvi],[xvii] Στη θεραπεία της ψωρίασης εξακολουθούν να υπάρχουν ανεκπλήρωτες ανάγκες. Σε μία έρευνα, περίπου 30% των ασθενών με ψωρίαση ανέφεραν ότι οι κύριοι στόχοι της θεραπείας τους, και συγκεκριμένα η διατήρηση του ελέγχου των συμπτωμάτων, η μείωση του κνησμού και η ελάττωση της αποφολίδωσης, δεν επιτεύχθηκαν με την τρέχουσα θεραπεία τους.[xviii] Η μη επίτευξη ή διατήρηση πλήρους και διαρκούς κάθαρσης του δέρματος επηρεάζει αρνητικά την εξέλιξη της νόσου και την ποιότητα ζωής των ασθενών.[xix]
Σχετικά με την BE RADIANT
Η BE RADIANT είναι μια τυχαιοποιημένη, πολυκεντρική, διπλά-τυφλή, παράλληλης ομάδας και ελεγχόμενη με ενεργό δραστικό παράγοντα μελέτη, η οποία έχει σχεδιαστεί για την αξιολόγηση της αποτελεσματικότητας και της ασφάλειας του bimekizumab σε σύγκριση με το secukinumab σε ενήλικες ασθενείς με μέτρια έως σοβαρή, χρόνια, ψωρίαση κατά πλάκας. Στη BE RADIANT εντάχθηκαν 743 ασθενείς που παρουσίαζαν ψωρίαση για διάστημα τουλάχιστον 6 μηνών πριν την ένταξη τους στη μελέτη, και κατά την αρχική επίσκεψη αξιολόγησης είχαν PASI ≥12, συνολική επιφάνεια σώματος με ψωρίαση (BSA) ≥10% και γενική αξιολόγηση ερευνητή (IGA) ≥3.
Οι ασθενείς τυχαιοποιήθηκαν σε bimekizumab ( 320 mg κάθε 4 εβδομάδες, Q4W) ή σε secukinumab ( 300 mg εβδομαδιαίως μέχρι την 4η εβδομάδα και στη συνέχεια κάθε 4 εβδομάδες, Q4W) .3 Από τη 16η εβδομάδα οι ασθενείς που έλαβαν bimekizumab τυχαιοποιήθηκαν σε μηνιαία ( Q4W) ή διμηνιαία χορήγηση ( Q8W). Tο πρωτεύον καταληκτικό σημείο ήταν η επίτευξη του PASI 100 τη 16η εβδομάδα. Τα κύρια δευτερεύοντα καταληκτικά σημεία συμπεριέλαβαν την επίτευξη PASI 100 την 48η εβδομάδα και PASI 75 την 4η εβδομάδα.1 Σε συνέχεια της διπλά τυφλής περιόδου των 48 εβδομάδων οι ασθενείς είχαν τη δυνατότητα να ενταχθούν σε μια συνεχιζόμενη ανοιχτή μελέτη διάρκειας 96 εβδομάδων
Η UCB ανακοίνωσε τα κύρια αποτελέσματα της BE RADIANT τον Ιούλιο του 2020.
Σχετικά με τη BE SURE2
Η BE SURE είναι μια τυχαιοποιημένη διπλά τυφλή Φάσης 3 μελέτη, η οποία έχει σχεδιαστεί για την αξιολόγηση της αποτελεσματικότητας και της ασφάλειας του bimekizumab σε σύγκριση με το adalimumab σε ενήλικες ασθενείς με μέτρια έως σοβαρή, χρόνια, ψωρίαση κατά πλάκας. Η ελεγχόμενη με ενεργό παράγοντα αρχική περίοδος θεραπείας 24 εβδομάδων, ακολουθήθηκε από μια περίοδο θεραπείας 24 εβδομάδων με τυφλή δόση μέχρι την εβδομάδα 56.
Στην BE SURE εντάχθηκαν 478 ασθενείς που παρουσίαζαν ψωρίαση κατά πλάκας για διάστημα τουλάχιστον 6 μηνών πριν την ένταξη τους στη μελέτη και κατά την αρχική επίσκεψη αξιολόγησης είχαν PASI ≥12, συνολική επιφάνεια σώματος με ψωρίαση (BSA) ≥10% και γενική αξιολόγηση ερευνητή (IGA) ≥3. Τα δευτερεύοντα τελικά σημεία ήταν η ανταπόκριση κατά PASI 90 και IGA τη 16η εβδομάδα.
Σχετικά με την UCB
Η UCB, με έδρα στις Βρυξέλλες του Βελγίου (www.ucb.com), είναι μία βιοφαρμακευτική εταιρεία με παρουσία σε όλο τον κόσμο που επικεντρώνεται στην ανακάλυψη και ανάπτυξη καινοτόμων φαρμάκων και άλλων λύσεων, με στόχο την βελτίωση της ζωής όσων πάσχουν από σοβαρά νοσήματα του ανοσοποιητικού ή του κεντρικού νευρικού συστήματος. Η εταιρεία απασχολεί πάνω από 8.400 άτομα σε περίπου 40 χώρες και το 2020 κατέγραψε έσοδα 5,3 δισεκατομμυρίων ευρώ. Η UCB είναι εισηγμένη στο Euronext Brussels (σύμβολο: UCB). Ακολουθήστε μας στο Twitter: @UCB_news
Δηλώσεις πρόβλεψης
Αυτό το δελτίο τύπου περιέχει δηλώσεις πρόβλεψης συμπεριλαμβανομένων, χωρίς περιορισμό, δηλώσεων που περιέχουν τις λέξεις “πιστεύει”, “αναμένει”, “προτίθεται”, “σχεδιάζει”, “επιδιώκει”, “εκτιμήσεις”, “μπορεί”, “θα”, “συνεχώς” και παρόμοιες εκφράσεις. Οι δηλώσεις αυτές βασίζονται στα τρέχοντα σχέδια, τις εκτιμήσεις και τις πεποιθήσεις της διοίκησης. Όλες οι δηλώσεις, εκτός από όσες αφορούν ιστορικά γεγονότα, είναι δηλώσεις που θα μπορούσαν να θεωρηθούν δηλώσεις πρόβλεψης και αφορούν σε εκτιμήσεις για τα έσοδα, τα κέρδη εκμετάλλευσης, τις κεφαλαιουχικές δαπάνες, τα μετρητά και λοιπές οικονομικές πληροφορίες, αναμενόμενα νομικά, πολιτικά, ρυθμιστικά ή κλινικά αποτελέσματα, καθώς και άλλες ανάλογες εκτιμήσεις και αποτελέσματα.
Από τη φύση τους, τέτοιες δηλώσεις πρόβλεψης δεν αποτελούν εγγύηση για τη μελλοντική απόδοση και ενέχουν κινδύνους, αβεβαιότητες και υποθέσεις που ενδέχεται να οδηγήσουν σε ουσιαστική διαφοροποίηση των πραγματικών αποτελεσμάτων από τα αποτελέσματα που εκφράζονται εμμέσως στις δηλώσεις πρόβλεψης που περιέχονται στο παρόν δελτίο τύπου. Σημαντικοί παράγοντες που μπορεί να οδηγήσουν σε αυτή τη διαφοροποίηση είναι: η παγκόσμια εξάπλωση και τον αντίκτυπο του COVID-19, αλλαγές στις γενικές οικονομικές, επιχειρηματικές και ανταγωνιστικές συνθήκες, αδυναμία λήψης των απαραίτητων ρυθμιστικών εγκρίσεων ή λήψη εγκρίσεων με αποδεκτούς όρους, ή εντός του αναμενόμενου χρονοδιαγράμματος, κόστος που σχετίζεται με την έρευνα και την ανάπτυξη, αλλαγές των προοπτικών για τα προϊόντα που προορίζονται για ανάπτυξη ή βρίσκονται στο στάδιο της ανάπτυξης από την UCB, επιδράσεις μελλοντικών δικαστικών αποφάσεων ή κυβερνητικών ερευνών, αξιώσεις αστικής ευθύνης λόγω ελαττωματικών προϊόντων, προκλήσεις που αφορούν την προστασία των διπλωμάτων ευρεσιτεχνίας για προϊόντα ή υποψήφια προϊόντα, αλλαγές στους νόμους ή κανονισμούς, διακυμάνσεις της συναλλαγματικής ισοτιμίας, αλλαγές ή αβεβαιότητες στη φορολογική νομοθεσία ή στην εφαρμογή της, πρόσληψη και διατήρηση των υπαλλήλων. Δεν υπάρχει εγγύηση ότι τα νέα υποψήφια προϊόντα που βρίσκονται στο στάδιο της ανάπτυξης θα φθάσουν έως την έγκριση ή ότι θα αναπτυχθούν και θα εγκριθούν νέες ενδείξεις για τα υπάρχοντα προϊόντα. Η μετάβαση από την ερευνητική ιδέα στο εμπορικό προϊόν είναι αβέβαιη. Τα προκλινικά δεδομένα δεν εγγυώνται την ασφάλεια και την αποτελεσματικότητα των ερευνητικών προϊόντων στον άνθρωπο. Μέχρι στιγμής, η πολυπλοκότητα του ανθρώπινου σώματος δεν μπορεί να αναπαραχθεί σε μοντέλα υπολογιστών, συστήματα κυτταροκαλλιέργειας ή ζωικά μοντέλα. Η χρονική διάρκεια για την ολοκλήρωση των κλινικών δοκιμών και την έγκριση από τις ρυθμιστικέ αρχές για την κυκλοφορία των προϊόντων ποικίλει, και UCB αναμένει παρόμοια αβεβαιότητα και στο μέλλον. Τα προϊόντα ή τα υποψήφια προϊόντα που αποτελούν το αντικείμενο συνεταιρισμού, κοινοπραξίας ή συνεργασίας αδειοδότησης μπορεί να υπόκεινται σε διαφορές μεταξύ των συνεργατών ή μπορεί να αποδειχθεί ότι τα προϊόντα αυτά δεν είναι τόσο ασφαλή, αποτελεσματικά ή εμπορικά επιτυχή όσο μπορεί να πίστευε η UCB κατά την έναρξη της εν λόγω συνεταιρισμού. Οι προσπάθειες της UCB να αποκτήσει άλλα προϊόντα ή εταιρείες και να ενσωματώσει τις δραστηριότητες των εν λόγω αποκτηθεισών εταιρειών μπορεί να μην είναι τόσο επιτυχείς όσο η UCB μπορεί να πίστευε κατά τη στιγμή της εξαγοράς. Επίσης, η UCB, ή άλλα μέρη, ενδέχεται να ανακαλύψουν προβλήματα που αφορούν στην ασφάλεια, σε ανεπιθύμητα συμβάντα ή στην παρασκευή των προϊόντων μετά την κυκλοφορία τους. Η ανακάλυψη σημαντικών προβλημάτων με ένα προϊόν παρόμοιο με ένα από τα προϊόντα της UCB που εμπλέκουν μια ολόκληρη κατηγορία προϊόντων μπορεί να έχει σημαντικές δυσμενείς επιπτώσεις στις πωλήσεις ολόκληρης της κατηγορίας των προϊόντων. Επιπλέον, οι πωλήσεις ενδέχεται να επηρεαστούν από διεθνείς και εγχώριες τάσεις στη διαχειριζόμενη φροντίδα και τον περιορισμό του κόστους της υγειονομικής περίθαλψης,πολιτικό και δημόσιο έλεγχο, πρότυπα ή πρακτικές πελατών και συνταγογράφων, από τις πολιτικές αποζημίωσης τρίτων ασφαλιστικών φορέων, καθώς και από τη νομοθεσία που ρυθμίζει την τιμολόγηση και την αποζημίωση βιοφαρμακευτικών προϊόντων. Τέλος, μια βλάβη, μια κυβερνοεπίθεση ή παραβίαση της ασφάλειας των πληροφοριών θα μπορούσε να θέσει σε κίνδυνο την εμπιστευτικότητα, την ακεραιότητα και τη διαθεσιμότητα των δεδομένων και των συστημάτων της UCB
Δεδομένων αυτών των αβεβαιοτήτων, δεν θα πρέπει να βασίζεστε αδικαιολόγητα σε καμία από αυτές τις δηλώσεις πρόβλεψης. Δεν μπορεί να υπάρχει εγγύηση ότι τα προϊόντα που περιγράφονται στο παρόν δελτίο Τύπου θα υποβληθούν ή θα εγκριθούν προς διάθεση ή για τυχόν πρόσθετες ενδείξεις ή επισήμανση σε οποιαδήποτε αγορά, ή σε οποιαδήποτε συγκεκριμένη στιγμή, ούτε μπορεί να υπάρξει εγγύηση ότι τα προϊόντα αυτά θα είναι ή θα συνεχίσουν να είναι εμπορικά επιτυχή στο μέλλον.
Η UCB παρέχει αυτές τις πληροφορίες, συμπεριλαμβανομένων των δηλώσεων πρόβλεψης, μόνο κατά την ημερομηνία του παρόντος δελτίου τύπου και δεν αντικατοπτρίζει τυχόν επιπτώσεις από την εξελισσόμενη πανδημία COVID-19, εκτός εάν ορίζεται διαφορετικά. Η UCB παρακολουθεί επιμελώς τις παγκόσμιες εξελίξεις για να αξιολογήσει την οικονομική επίπτωση αυτής της πανδημίας για την UCB. Η UCB αποποιείται ρητά κάθε υποχρέωση να ενημερώνει κάθε πληροφορία που περιέχεται στο παρόν δελτίο Τύπου, είτε για την επιβεβαίωση των πραγματικών αποτελεσμάτων είτε για την αναφορά ή την επίδραση οποιασδήποτε αλλαγής στις μελλοντικές δηλώσεις της σε σχέση με αυτά ή για οποιαδήποτε αλλαγή γεγονότων, όρων ή περιστάσεων στις οποίες βασίζεται οποιαδήποτε τέτοια δήλωση, εκτός εάν απαιτείται τέτοια δήλωση σύμφωνα με τους ισχύοντες νόμους και κανονισμούς.
Επιπρόσθετα, οι πληροφορίες που περιέχονται στο παρόν έγγραφο δε συνιστούν προσφορά για την πώληση ή προσέλκυση προσφορών για την αγορά χρεογράφων, ούτε θα υπάρξει οποιαδήποτε προσφορά, προσέλκυση ή πώληση χρεογράφων σε οποιαδήποτε δικαιοδοσία στην οποία τέτοιου είδους προσφορά, προσέλκυση ή πώληση θα ήταν παράνομη πριν από την εγγραφή ή την πιστοποίηση σύμφωνα με τους νόμους περί χρεογράφων της εν λόγω δικαιοδοσίας.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον Κόσμο
Ακολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube