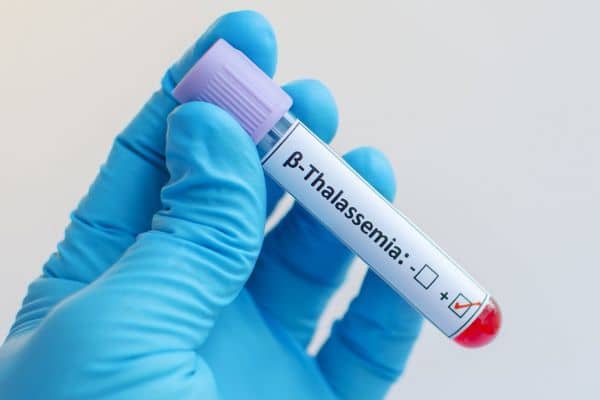
Το ιατρικό περιοδικό New England Journal of Medicine δημοσιεύει αποτελέσματα από την πιλοτική μελέτη Φάσης 3 BELIEVE του luspatercept-aamt σε ενήλικους ασθενείς με β-θαλασσαιμία
Τα αποτελέσματα καταδεικνύουν ότι η θεραπεία με luspatercept-aamt πρoσφέρει σημαντική μείωση του φορτίου μεταγγίσεων για ασθενείς με αναιμία σχετιζόμενη με β-θαλασσαιμία, σε σύγκριση με θεραπεία με εικονικό φάρμακο
Η Bristol-Myers Squibb (NYSE: BMY) και η Acceleron Pharma Inc. (NASDAQ: XLRN) ανακοίνωσαν σπρόσφατα ότι το επιστημονικό περιοδικό New England Journal of Medicine (NEJM) δημοσίευσε αποτελέσματα από τη μελέτη BELIEVE, την πιλοτική μελέτη Φάσης 3 που αξιολογεί την ασφάλεια και την αποτελεσματικότητα του luspatercept-aamt στη θεραπεία της αναιμίας σε ενήλικες με β-θαλασσαιμία οι οποίοι έχουν ανάγκη τακτικών μεταγγίσεων ερυθρών αιμοσφαιρίων (RBC).
Στην Ελλάδα, τα εξής 5 ερευνητικά κέντρα συμμετείχαν στη μελέτη BELIEVE :
- Κέντρο Αναφοράς Πρόληψης Θαλασσαιμίας και Δρεπανοκυτταρικής Νόσου, Γ.Ν.Α “Λαϊκό”, Αθήνα
- Μονάδα Μεσογειακής Αναιμίας, Α’ Παιδιατρική Κλινική, ΕΚΠΑ, Νοσοκομείο Παίδων «Η Αγία Σοφία», Αθήνα
- Μονάδα Θαλασσαιμίας, Β΄ Παθολογική Κλινική, Γ.Ν.Θ “Ιπποκράτειο”, Θεσσαλονίκη
- Μονάδα Θαλασσαιμίας και Αιμοσφαιρινοπαθειών/Τμήμα Αιματολογίας, Τμήμα Γενικής Παθολογίας, Π.Γ.Ν. Πατρών, Ρίο
- Μονάδα Μεσογειακής Αναιμίας, Γ.Ν.Α «Γ. Γεννηματάς», Αθήνα
«Τα αποτελέσματα που δημοσιεύτηκαν στο ιατρικό περιοδικό New England Journal of Medicine καταδεικνύουν το κλινικό όφελος του luspatercept-aamt, της πρώτης εγκεκριμένης θεραπείας για την αναιμία που σχετίζεται με β-θαλασσαιμία στις ΗΠΑ» δήλωσε η Diane McDowell, M.D., αντιπρόεδρος του Τμήματος Παγκόσμιων Ιατρικών Υποθέσεων στον τομέα της Αιματολογίας της Bristol-Myers Squibb. «Οι ασθενείς με β-θαλασσαιμία πάσχουν από χρόνια αναιμία που συχνά απαιτεί διά βίου θεραπεία με μεταγγίσεις ερυθρών αιμοσφαιρίων, οι οποίες σχετίζονται με πολλές ιατρικές επιπλοκές.1 Η ικανότητα του luspatercept-aamt να μειώνει τη συχνότητα και το φορτίo των τακτικών μεταγγίσεων ερυθρών αιμοσφαιρίων είναι κλινικά σημαντική για τους παραπάνω ασθενείς».
Στην κλινική μελέτη BELIEVE, ένα σημαντικά υψηλότερο ποσοστό ασθενών που λάμβαναν θεραπεία με luspatercept-aamt σημείωσε μείωση κατά >33% στο φορτίο μετάγγισης ερυθρών αιμοσφαιρίων (RBC) από την έναρξη της μελέτης (με μείωση τουλάχιστον δύο μονάδων) κατά τις εβδομάδες 13-24, σε σύγκριση με θεραπεία με εικονικό φάρμακο, πετυχαίνοντας το κύριο καταληκτικό σημείο της μελέτης. Η μελέτη πέτυχε επίσης όλα τα κύρια δευτερεύοντα καταληκτικά σημεία, καθώς, σε σύγκριση με θεραπεία με εικονικό φάρμακο, ένα σημαντικά υψηλότερο ποσοστό ασθενών που λάμβαναν θεραπεία με luspatercept-aamt σημείωσε μείωση κατά >33% στο φορτίο μετάγγισης ερυθρών αιμοσφαιρίων (RBC) κατά τις εβδομάδες 37-48 και μείωση κατά >50% κατά τις εβδομάδες 13-24 ή τις εβδομάδες 37-48.2
Οι πιο συχνές ανεπιθύμητες ενέργειες (AEs) οποιουδήποτε βαθμού που εμφανίστηκαν σε ποσοστό μεγαλύτερο του 5% των ασθενών που λάμβαναν θεραπεία με luspatercept-aamt, σε σύγκριση με την ομάδα θεραπείας με εικονικό φάρμακο, ήταν οστικό άλγος (19,7% έναντι 8,3%), αρθραλγία (19,3% έναντι 11,9%), ζάλη (11,2% έναντι 4,6%), υπέρταση (8,1% έναντι 2,8%) και υπερουριχαιμία (7,2% έναντι 0%). Ανεπιθύμητες ενέργειες βαθμού >3 οφειλόμενες στη θεραπεία αναφέρθηκαν σε μεγαλύτερο ποσοστό ασθενών που λάμβαναν θεραπεία με luspatercept-aamt, σε σύγκριση με θεραπεία με εικονικό φάρμακο (29,1% έναντι 15,6%). Οι πιο συχνές ανεπιθύμητες ενέργειες βαθμού >3 που αναφέρθηκαν με το luspatercept-aamt ήταν αναιμία (3,1% έναντι 0%), αυξημένη συγκέντρωση σιδήρου στο ήπαρ (2,7% έναντι 0,9%) και υπερουριχαιμία (2,7% έναντι 0%) σε σύγκριση με θεραπεία με εικονικό φάρμακο, αντίστοιχα. Σοβαρές ανεπιθύμητες ενέργειες αναφέρθηκαν στο 15,2% των ασθενών που λάμβαναν luspatercept-aamt και στο 5,5% των ασθενών που λάμβαναν εικονικό φάρμακο.2
«Είμαστε ιδιαίτερα περήφανοι που το ιατρικό περιοδικό New England Journal of Medicine επέλεξε να δημοσιεύσει δεδομένα από δύο πιλοτικές μελέτες του luspatercept-aamt, ξεκινώντας τον περασμένο Ιανουάριο με τη δημοσίευση των αποτελεσμάτων της μελέτης MEDALIST σε έναν πληθυσμό ασθενών με μυελοδυσπλαστικά σύνδρομα», δήλωσε ο Habib Dable, Πρόεδρος και Chief Executive Officer της Acceleron. «Με τη σημερινή δημοσίευση δεδομένων από τη μελέτη BELIEVE σε ένα σύνολο ασθενών με β-θαλασσαιμία, είμαστε πεπεισμένοι ότι οι θεράποντες ιατροί και οι ασθενείς θα είναι καλύτερα ενημερωμένοι για μια νέα πιθανή θεραπεία κατά της σοβαρής αναιμίας που σχετίζεται με δύο παθήσεις με σημαντική ανεκπλήρωτη ιατρική ανάγκη».
Τα αποτελέσματα από τη μελέτη BELIEVE υποστήριξαν την έγκριση του luspatercept-aamt από τον Οργανισμό Τροφίμων και Φαρμάκων (FDA) των ΗΠΑ, η οποία δόθηκε τον Νοέμβριο του 2019 για τη θεραπεία της αναιμίας σε ενήλικους ασθενείς με β-θαλασσαιμία που έχουν ανάγκη τακτικών μεταγγίσεων ερυθρών αιμοσφαιρίων. Τα αποτελέσματα αυτά είχαν προηγουμένως παρουσιαστεί στο 60ο Ετήσιο Συνέδριο της Αμερικανικής Αιματολογικής Εταιρείας (American Society of Hematology – ASH) τον Δεκέμβριο του 2018.). Πιο μακροπρόθεσμες αναλύσεις από τη μελέτη BELIEVE παρουσιάστηκαν στο 61ο Ετήσιο Συνέδριο της Αμερικανικής Αιματολογικής Εταιρείας (ASH) τον Δεκέμβριο του 2019.
Το luspatercept-aamt δεν ενδείκνυται για χρήση ως υποκατάστατο των μεταγγίσεων ερυθρών αιμοσφαιρίων (RBC) σε ασθενείς που έχουν ανάγκη άμεσης διόρθωσης της αναιμίας.

Σχετικά με τη μελέτη BELIEVE
Η μελέτη BELIEVE είναι μια τυχαιοποιημένη, διπλά τυφλή, ελεγχόμενη με εικονικό φάρμακο πολυκεντρική μελέτη Φάσης 3 που συγκρίνει το luspatercept-aamt, σε συνδυασμό με βέλτιστη υποστηρικτική αγωγή (BSC), έναντι εικονικού φαρμάκου και βέλτιστης υποστηρικτικής αγωγής (BSC) σε ενήλικους ασθενείς που έχουν ανάγκη τακτικών μεταγγίσεων ερυθρών αιμοσφαιρίων λόγω β-θαλασσαιμίας2 (6-20 μονάδες ερυθρών αιμοσφαιρίων ανά 24 εβδομάδες χωρίς το διάστημα κατά το οποίο δεν πραγματοποιείται μετάγγιση να υπερβαίνει τις 35 ημέρες). Η βέλτιστη υποστηρικτική αγωγή (BSC) περιλάμβανε μεταγγίσεις ερυθρών αιμοσφαιρίων, παράγοντες αποσιδήρωσης, χρήση αντιβιωτικής, αντι-ιικής και αντιμυκητιασικής θεραπείας και/ή διατροφική υποστήριξη ανάλογα με τις ανάγκες.2
Bristol Myers Squibb: Προωθώντας την Έρευνα στον Καρκίνο
Στην Bristol Myers Squibb, οι ασθενείς βρίσκονται στο επίκεντρο των δράσεων μας. Στόχος της έρευνάς μας στον καρκίνο είναι να αυξήσουμε την ποιοτική μακροχρόνια επιβίωση και να καταστήσουμε εφικτή την ίαση. Αξιοποιούμε τη βαθιά επιστημονική εμπειρία μας, τις πρωτοποριακές τεχνολογίες και πλατφόρμες ανακάλυψης για να ανακαλύπτουμε, να αναπτύσσουμε και να προσφέρουμε νέες θεραπείες για τους ασθενείς.
Εξελίσσοντας τα επιτεύγματά μας και αξιοποιώντας την κληρονομιά μας στους τομείς της αιματολογίας και της ανοσο-ογκολογίας (I-O), που έχουν αλλάξει το προσδόκιμο επιβίωσης στην περίπτωση πολλών τύπων καρκίνου, οι ερευνητές μας προωθούν μια ευρεία και ποικιλόμορφη γραμμή παραγωγής πολλών θεραπείων. Στο πεδίο της ανοσοκυτταρικής θεραπείας, αυτή περιλαμβάνει παράγοντες με CAR T-λεμφοκύτταρα (T-λεμφοκύτταρα που φέρουν χιμαιρικό υποδοχέα αντιγόνου/chimeric antigen receptor T-cells) που βρίσκονται σε στάδιο έγκρισης για πολλές νόσους, καθώς και μια εξελισσόμενη γραμμή αρχικού σταδίου για την ανάπτυξη στόχων και τεχνολογιών κυτταρικής και γονιδιακής θεραπείας. Αναπτύσσουμε αντικαρκινικές θεραπείες που στοχεύουν βασικά βιολογικά μονοπάτια χρησιμοποιώντας την πλατφόρμα πρωτεϊνικής ομοιόστασης της εταιρείας μας, ένα ερευνητικό εργαλείο που αποτελεί τη βάση των εγκεκριμένων θεραπειών μας για το πολλαπλό μυέλωμα και αρκετών ελπιδοφόρων μορίων που βρίσκονται σε αρχικό ή μεσαίο στάδιο ανάπτυξης. Οι επιστήμονές μας στοχεύουν διαφορετικά μονοπάτια του ανοσοποιητικού συστήματος για να παρεμβαίνουν στις αλληλεπιδράσεις ανάμεσα στους όγκους, το μικροπεριβάλλον τους και το ανοσοποιητικό σύστημα, προκειμένου να επεκτείνουν την πρόοδο που έχουμε σημειώσει και να βοηθήσουν περισσότερους ασθενείς να ανταποκριθούν στη θεραπεία. Ο συνδυασμός αυτών των προσεγγίσεων είναι καθοριστικής σημασίας για να προσφέρουμε νέες επιλογές για τη θεραπεία του καρκίνου και την αντιμετώπιση του αυξανόμενου προβλήματος της ανθεκτικότητας στην ανοσοθεραπεία. Οι καινοτομίες μας βασίζονται σε εσωτερικούς πόρους, καθώς και τη συνεργασία με μέλη της ακαδημαϊκής κοινότητας, κυβερνήσεις, ομάδες υποστήριξης και εταιρείες βιοτεχνολογίας, με στόχο να υλοποιήσουμε την υπόσχεση της παροχής φαρμάκων που αλλάζουν τις ζωές των ασθενών.
Σχετικά με το luspatercept-aamt
Το luspatercept-aamt αποτελεί έναν παράγοντα ωρίμανσης ερυθρών (erythroid maturation agent – EMA) που προήγαγε την ωρίμανση τελικής φάσης των ερυθρών αιμοσφαιρίων σε ζωικά μοντέλα.3 Η Bristol Myers Squibb και η Acceleron αναπτύσσουν από κοινού το luspatercept-aamt στο πλαίσιο μιας παγκόσμιας συνεργασίας. Επί του παρόντος, το luspatercept-aamt είναι εγκεκριμένο στις ΗΠΑ για τη θεραπεία της αναιμίας σε ενήλικους ασθενείς με β-θαλασσαιμία οι οποίοι έχουν ανάγκη τακτικών μεταγγίσεων ερυθρών αιμοσφαιρίων αλλά και για τη θεραπεία της αναιμίας σε ενηλίκους ασθενείς με μυελοδυσπλαστικά σύνδρομα (ΜΔΣ) πολύ χαμηλού έως μέτριου κινδύνου, οι οποίοι έχουν δακτυλιοειδείς σιδηροβλάστες και έχουν ανάγκη τακτικών μεταγγίσεων ερυθρών αιμοσφαιρίων.. Το luspatercept-aamt δεν ενδείκνυται για χρήση ως υποκατάστατο των μεταγγίσεων ερυθρών αιμοσφαιρίων σε ασθενείς που έχουν ανάγκη άμεση διόρθωση της αναιμίας.
Στην Ευρώπη, η Αίτηση Άδειας Κυκλοφορίας (MAA) της Bristol Myers Squibb για τη θεραπεία της αναιμίας σε ενήλικες με β-θαλασσαιμία και ΜΔΣ βρίσκεται υπό αξιολόγηση.
Πρόσθετες κλινικές έρευνες
Μία κλινική μελέτη Φάσης 2 (BEYOND) σε ενήλικους ασθενείς με μη μεταγγισιοεξαρτώμενη β-θαλασσαιμία,4 μία κλινική μελέτη Φάσης 2 σε παιδιατρικούς ασθενείς με μεταγγισιοεξαρτώμενη β-θαλασσαιμία,5 μία κλινική μελέτη Φάσης 3 (COMMANDS) σε ασθενείς με χαμηλότερου κινδύνου ΜΔΣ που δεν έχουν λάβει θεραπεία με παράγοντες διέγερσης ερυθροποίησης6, καθώς και μία μελέτη Φάσης 2 σε ασθενείς με μυελοΐνωση, βρίσκονται σε εξέλιξη.7 Οι εταιρείες επίσης σχεδιάζουν μία μελέτη Φάσης 3 για το 2020, γνωστή ως INDEPENDENCE, στη μυελοΐνωση.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον Κόσμο
Ακολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube