Η Ευρωπαϊκή Επιτροπή ενέκρινε το isatuximab σε συνδυασμό με πομαλιδομίδη και δεξαμεθαζόνη για τη θεραπεία ενηλίκων ασθενών με υποτροπιάζον και ανθεκτικό πολλαπλό μυέλωμα, οι οποίοι έχουν λάβει τουλάχιστον δύο προηγούμενες θεραπείες, συμπεριλαμβανομένων της λεναλιδομίδης και ενός αναστολέα πρωτεασώματος, και εμφάνισαν εξέλιξη της νόσου με την τελευταία θεραπεία.
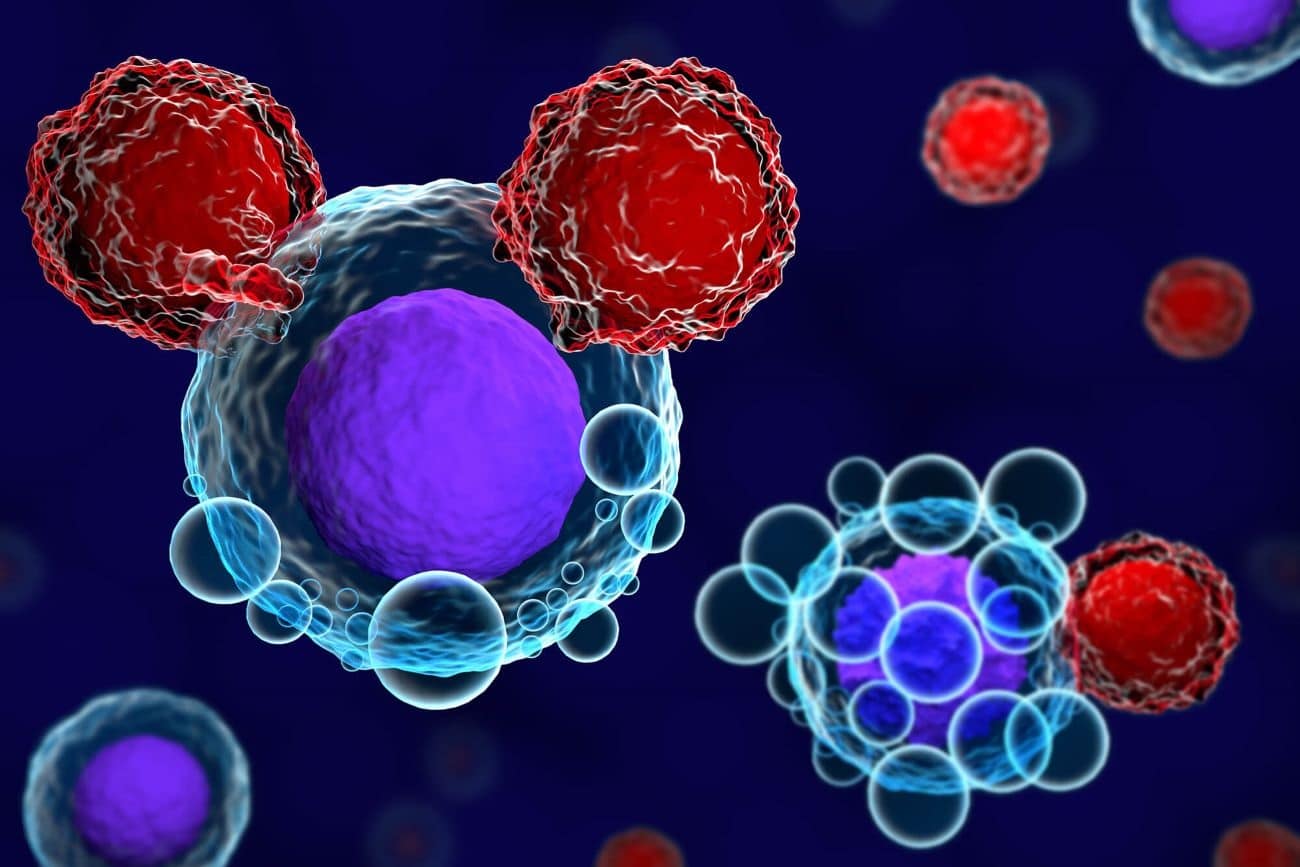
Το isatuximab είναι ένα μονοκλωνικό αντίσωμα (mAb), το οποίο συνδέεται σε έναν ειδικό επίτοπο του υποδοχέα CD38 στα κύτταρα του πολλαπλού μυελώματος.
«Η έγκριση του isatuximab από την Ευρωπαϊκή Επιτροπή αντιπροσωπεύει μια σημαντική πρόσθετη θεραπευτική επιλογή και ενδέχεται να δημιουργήσει ένα νέο πρότυπο φροντίδας για τους ασθενείς με μυέλωμα στην Ευρώπη, οι οποίοι έχουν ανάγκη για νέες αποτελεσματικές θεραπείες λόγω επανεμφάνισης της νόσου ή ανθεκτικότητας στην προηγούμενη θεραπεία τους», δήλωσε ο John Reed, M.D., Ph.D., Global Head of Research and Development της Sanofi. «Το isatuximab σε συνδυασμό με πομαλιδομίδη και δεξαμεθαζόνη κατέδειξε διάμεση επιβίωση χωρίς εξέλιξη της νόσου σχεδόν ενός έτους, καταγράφοντας βελτίωση πέντε μηνών έναντι της θεραπείας με το συνδυασμό πομαλιδομίδης και δεξαμεθαζόνης, σε ασθενείς οι οποίοι είχαν εξέλιξη της νόσου με τουλάχιστον δύο προηγούμενες θεραπείες».
Αποτελεσματικότητα και προφίλ ασφάλειας του isatuximab σε ασθενείς με δύσκολη θεραπευτική προσέγγιση
Στη μελέτη Φάσης 3 ICARIA-MM, η προσθήκη του isatuximab στη θεραπεία με πομαλιδομίδη και δεξαμεθαζόνη (συνδυαστική θεραπεία με isatuximab, n=154) κατέδειξε στατιστικώς σημαντική βελτίωση της επιβίωσης χωρίς εξέλιξη της νόσου (PFS), με διάμεση επιβίωση χωρίς εξέλιξη της νόσου 11,53 μηνών, έναντι 6,47 μηνών με τη θεραπεία συνδυασμού πομαλιδομίδης και δεξαμεθαζόνης μόνο (n=153) (HR 0,596, 95% CI: 0,44-0,81, p=0,001). Επιπλέον, η συνδυαστική θεραπεία με isatuximab έδειξε στατιστικώς σημαντικά υψηλότερο ποσοστό συνολικής ανταπόκρισης σε σύγκριση με τον συνδυασμό πομαλιδομίδης και δεξαμεθαζόνης (60,4% έναντι 35,3%, p<0,0001). Σε πρόσθετες αναλύσεις, η συνδυαστική θεραπεία με isatuximab σε σύγκριση με τη θεραπεία συνδυασμού πομαλιδομίδης και δεξαμεθαζόνης, κατέδειξε θεραπευτικό όφελος σε όλες τις επιλεγμένες υποομάδες που αντικατοπτρίζουν την καθημερινή κλινική πρακτική, συμπεριλαμβανομένων ασθενών με κυτταρογενετικές ανωμαλίες υψηλού κινδύνου, ασθενών ηλικίας 75 ετών και άνω, ασθενών με νεφρική δυσλειτουργία, καθώς και εκείνων που ήταν ανθεκτικοί στη λεναλιδομίδη.
«Όταν οι ασθενείς εμφανίζουν υποτροπή του πολλαπλού μυελώματος ή γίνονται ανθεκτικοί στη θεραπεία που ακολουθούν, η αντιμετώπιση της νόσου γίνεται δυσκολότερη και η πρόγνωση δυσμενέστερη. Στη μελέτη ICARIA-MM, η συνδυαστική θεραπεία με isatuximab έδειξε σταθερό θεραπευτικό όφελος στις υποομάδες ασθενών με υποτροπιάζον και ανθεκτικό πολλαπλό μυέλωμα», δήλωσε ο Philippe Moreau, M.D., Τμήμα Αιματολογίας του Πανεπιστημιακού Νοσοκομείου της Νάντης στη Γαλλία. «Το isatuximab προσφέρει μια σημαντική νέα θεραπευτική επιλογή και μία δυνητικά νέα καθιερωμένη θεραπεία για εκείνους τους ασθενείς που πάσχουν από υποτροπιάζουσα, ανθεκτική νόσο».
Σύμφωνα με την περίληψη των χαρακτηριστικών του προϊόντος (ΠΧΠ), οι πιο συχνές ανεπιθύμητες ενέργειες που παρατηρήθηκαν με το isatuximab (που εμφανίστηκαν σε ποσοστό ασθενών ≥20%) είναι ουδετεροπενία (46,7%), αντιδράσεις σχετιζόμενες με την έγχυση (38,2%), πνευμονία (30,9%), λοίμωξη του ανώτερου αναπνευστικού (28,3%), διάρροια (25,7%) και βρογχίτιδα (23,7%). Οι πιο συχνές σοβαρές ανεπιθύμητες ενέργειες είναι πνευμονία (9,9%) και εμπύρετη ουδετεροπενία (6,6%).
Για περισσότερες πληροφορίες σχετικά με την ασφάλεια του isatuximab, ανατρέξτε στην περίληψη των χαρακτηριστικών του προϊόντος (ΠΧΠ).
Μια σημαντική νέα επιλογή για την αντιμετώπιση του πολλαπλού μυελώματος
Το isatuximab χορηγείται μέσω ενδοφλέβιας έγχυσης στη δόση των 10 mg/kg, σε συνδυασμό με πομαλιδομίδη και δεξαμεθαζόνη, εβδομαδιαίως για τέσσερις εβδομάδες και στη συνέχεια κάθε δεύτερη εβδομάδα, έως ότου εμφανιστεί εξέλιξη της νόσου ή μη αποδεκτή τοξικότητα. Με δεδομένο ότι δεν θα απαιτηθεί τροποποίηση του ρυθμού έγχυσης λόγω σχετιζόμενων με την έγχυση αντιδράσεων, η πρώτη έγχυση διαρκεί τρεις έως τέσσερις ώρες, η δεύτερη έγχυση διαρκεί λιγότερο από δύο ώρες και ο χρόνος για τις υπόλοιπες εγχύσεις είναι δυνατό να μειωθεί στα 75 λεπτά, από την τρίτη έγχυση και εξής. Ένας κύκλος θεραπείας αντιστοιχεί σε 28 ημέρες. Η άδεια κυκλοφορίας της Ευρωπαϊκής Επιτροπής για το isatuximab ισχύει στα 27 κράτη μέλη της Ευρωπαϊκής Ένωσης, καθώς και στο Ηνωμένο Βασίλειο, την Ισλανδία, το Λιχτενστάιν και τη Νορβηγία.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον ΚόσμοΑκολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube