Η Bristol Myers Squibb (NYSE: BMY) πρόσφατα ανακοίνωσε ότι η Ευρωπαϊκή Επιτροπή ενέκρινε το nivolumab για τη θεραπεία ενηλίκων με ανεγχείρητο προχωρημένο, υποτροπιάζον ή μεταστατικό καρκίνωμα του οισοφάγου εκ πλακωδών κυττάρων (ESCC) μετά από προηγούμενη συνδυαστική χημειοθεραπεία με βάση τη φθοριοπυριμιδίνη και την πλατίνα.
Η απόφαση της Ευρωπαϊκής Επιτροπής βασίζεται σε αποτελέσματα από τη μελέτη Φάσης 3 ATTRACTION-3, μια μελέτη χρηματοδοτούμενη από την Ono Pharmaceutical Co., Ltd. στην Ιαπωνία, τα οποία έδειξαν στατιστικά σημαντική και κλινικά ουσιαστική βελτίωση της συνολικής επιβίωσης (OS) σε ασθενείς οι οποίοι έλαβαν nivolumab έναντι χημειοθεραπείας. Το προφίλ ασφάλειας για το nivolumab ήταν ευνοϊκό σε σύγκριση με τη χημειοθεραπεία και αντίστοιχο με το προφίλ ασφάλειας σε προηγούμενες μελέτες του nivolumab σε άλλους συμπαγείς όγκους.
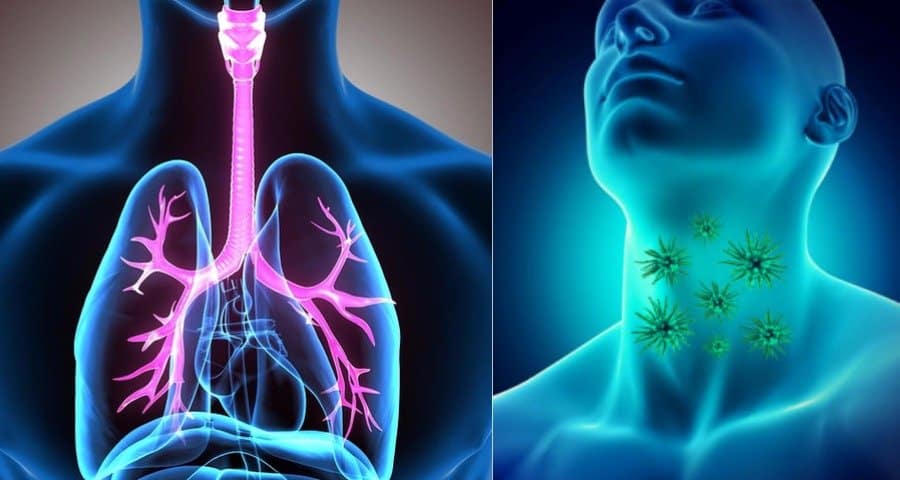
«Η σημερινή έγκριση αποτελεί ένα κρίσιμης σημασίας ορόσημο για τα άτομα που ζουν με καρκίνωμα του οισοφάγου εκ πλακωδών κυττάρων, καθώς σηματοδοτεί την πρώτη φορά που μια θεραπευτική επιλογή ανοσοθεραπείας λαμβάνει έγκριση στην Ευρωπαϊκή Ένωση για τον συγκεκριμένο πληθυσμό ασθενών», δήλωσε ο Ian M. Waxman, M.D., επικεφαλής ανάπτυξης του τμήματος καρκίνων του γαστρεντερικού συστήματος της Bristol Myers Squibb. «Είμαστε υπερήφανοι για το έργο μας στην προώθηση θεραπευτικών επιλογών για άτομα που ζουν με κάποια μορφή καρκίνου του ανώτερου γαστρεντερικού συστήματος και ανυπομονούμε να συνεργαστούμε με τους Ευρωπαίους εταίρους για να προσφέρουμε το nivolumab σε περισσότερους ασθενείς που κρίνονται κατάλληλοι για λήψη της θεραπείας και ενδεχομένως θα ωφεληθούν».«Η έγκριση της πρώτης ανοσοθεραπείας σαν θεραπεία δεύτερης γραμμής για τους ασθενείς με πλακώδη καρκινώματα του οισοφάγου αναμένεται να βελτιώσει εντυπωσιακά την κλινική πορεία των ασθενών για τους οποίους, οι έως τώρα θεραπευτικές επιλογές ήταν περιορισμένες και τις περισσότερες φορές ανεπαρκείς», δήλωσε ο Μιχάλης Καραμούζης, Ιατρός Παθολόγος – Ογκολόγος, Αναπληρωτής Καθηγητής στην Ιατρική Σχολή του Εθνικού και Καποδιστριακού Πανεπιστημίου Αθηνών.
Πέρα από τη συγκεκριμένη έγκριση στην Ευρωπαϊκή Ένωση, το nivolumab έχει λάβει έγκριση σε πέντε χώρες, συμπεριλαμβανομένων των Ηνωμένων Πολιτειών και της Ιαπωνίας, για τη δεύτερης γραμμής θεραπεία ασθενών με ανεγχείρητο προχωρημένο, υποτροπιάζον ή μεταστατικό καρκίνωμα του οισοφάγου εκ πλακωδών κυττάρων. Η Bristol Myers Squibb εκφράζει τις ευχαριστίες της στους ασθενείς και τους ερευνητές που συμμετείχαν στην κλινική μελέτη για τη σημαντική συμβολή τους.Η Bristol Myers Squibb (NYSE: BMY) πρόσφατα ανακοίνωσε ότι η Ευρωπαϊκή Επιτροπή ενέκρινε το nivolumab για τη θεραπεία ενηλίκων με ανεγχείρητο προχωρημένο, υποτροπιάζον ή μεταστατικό καρκίνωμα του οισοφάγου εκ πλακωδών κυττάρων (ESCC) μετά από προηγούμενη συνδυαστική χημειοθεραπεία με βάση τη φθοριοπυριμιδίνη και την πλατίνα.Η απόφαση της Ευρωπαϊκής Επιτροπής βασίζεται σε αποτελέσματα από τη μελέτη Φάσης 3 ATTRACTION-3, μια μελέτη χρηματοδοτούμενη από την Ono Pharmaceutical Co., Ltd. στην Ιαπωνία, τα οποία έδειξαν στατιστικά σημαντική και κλινικά ουσιαστική βελτίωση της συνολικής επιβίωσης (OS) σε ασθενείς οι οποίοι έλαβαν nivolumab έναντι χημειοθεραπείας. Το προφίλ ασφάλειας για το nivolumab ήταν ευνοϊκό σε σύγκριση με τη χημειοθεραπεία και αντίστοιχο με το προφίλ ασφάλειας σε προηγούμενες μελέτες του nivolumab σε άλλους συμπαγείς όγκους.

«Η σημερινή έγκριση αποτελεί ένα κρίσιμης σημασίας ορόσημο για τα άτομα που ζουν με καρκίνωμα του οισοφάγου εκ πλακωδών κυττάρων, καθώς σηματοδοτεί την πρώτη φορά που μια θεραπευτική επιλογή ανοσοθεραπείας λαμβάνει έγκριση στην Ευρωπαϊκή Ένωση για τον συγκεκριμένο πληθυσμό ασθενών», δήλωσε ο Ian M. Waxman, M.D., επικεφαλής ανάπτυξης του τμήματος καρκίνων του γαστρεντερικού συστήματος της Bristol Myers Squibb. «Είμαστε υπερήφανοι για το έργο μας στην προώθηση θεραπευτικών επιλογών για άτομα που ζουν με κάποια μορφή καρκίνου του ανώτερου γαστρεντερικού συστήματος και ανυπομονούμε να συνεργαστούμε με τους Ευρωπαίους εταίρους για να προσφέρουμε το nivolumab σε περισσότερους ασθενείς που κρίνονται κατάλληλοι για λήψη της θεραπείας και ενδεχομένως θα ωφεληθούν».«Η έγκριση της πρώτης ανοσοθεραπείας σαν θεραπεία δεύτερης γραμμής για τους ασθενείς με πλακώδη καρκινώματα του οισοφάγου αναμένεται να βελτιώσει εντυπωσιακά την κλινική πορεία των ασθενών για τους οποίους, οι έως τώρα θεραπευτικές επιλογές ήταν περιορισμένες και τις περισσότερες φορές ανεπαρκείς», δήλωσε ο Μιχάλης Καραμούζης, Ιατρός Παθολόγος – Ογκολόγος, Αναπληρωτής Καθηγητής στην Ιατρική Σχολή του Εθνικού και Καποδιστριακού Πανεπιστημίου Αθηνών.Πέρα από τη συγκεκριμένη έγκριση στην Ευρωπαϊκή Ένωση, το nivolumab έχει λάβει έγκριση σε πέντε χώρες, συμπεριλαμβανομένων των Ηνωμένων Πολιτειών και της Ιαπωνίας, για τη δεύτερης γραμμής θεραπεία ασθενών με ανεγχείρητο προχωρημένο, υποτροπιάζον ή μεταστατικό καρκίνωμα του οισοφάγου εκ πλακωδών κυττάρων. Η Bristol Myers Squibb εκφράζει τις ευχαριστίες της στους ασθενείς και τους ερευνητές που συμμετείχαν στην κλινική μελέτη για τη σημαντική συμβολή τους.
Η απόφαση της Ευρωπαϊκής Επιτροπής βασίζεται σε αποτελέσματα από τη μελέτη Φάσης 3 ATTRACTION-3, μια μελέτη χρηματοδοτούμενη από την Ono Pharmaceutical Co., Ltd. στην Ιαπωνία, τα οποία έδειξαν στατιστικά σημαντική και κλινικά ουσιαστική βελτίωση της συνολικής επιβίωσης (OS) σε ασθενείς οι οποίοι έλαβαν nivolumab έναντι χημειοθεραπείας. Το προφίλ ασφάλειας για το nivolumab ήταν ευνοϊκό σε σύγκριση με τη χημειοθεραπεία και αντίστοιχο με το προφίλ ασφάλειας σε προηγούμενες μελέτες του nivolumab σε άλλους συμπαγείς όγκους.«Η σημερινή έγκριση αποτελεί ένα κρίσιμης σημασίας ορόσημο για τα άτομα που ζουν με καρκίνωμα του οισοφάγου εκ πλακωδών κυττάρων, καθώς σηματοδοτεί την πρώτη φορά που μια θεραπευτική επιλογή ανοσοθεραπείας λαμβάνει έγκριση στην Ευρωπαϊκή Ένωση για τον συγκεκριμένο πληθυσμό ασθενών», δήλωσε ο Ian M. Waxman, M.D., επικεφαλής ανάπτυξης του τμήματος καρκίνων του γαστρεντερικού συστήματος της Bristol Myers Squibb. «Είμαστε υπερήφανοι για το έργο μας στην προώθηση θεραπευτικών επιλογών για άτομα που ζουν με κάποια μορφή καρκίνου του ανώτερου γαστρεντερικού συστήματος και ανυπομονούμε να συνεργαστούμε με τους Ευρωπαίους εταίρους για να προσφέρουμε το nivolumab σε περισσότερους ασθενείς που κρίνονται κατάλληλοι για λήψη της θεραπείας και ενδεχομένως θα ωφεληθούν».«Η έγκριση της πρώτης ανοσοθεραπείας σαν θεραπεία δεύτερης γραμμής για τους ασθενείς με πλακώδη καρκινώματα του οισοφάγου αναμένεται να βελτιώσει εντυπωσιακά την κλινική πορεία των ασθενών για τους οποίους, οι έως τώρα θεραπευτικές επιλογές ήταν περιορισμένες και τις περισσότερες φορές ανεπαρκείς», δήλωσε ο Μιχάλης Καραμούζης, Ιατρός Παθολόγος – Ογκολόγος, Αναπληρωτής Καθηγητής στην Ιατρική Σχολή του Εθνικού και Καποδιστριακού Πανεπιστημίου Αθηνών.
Πέρα από τη συγκεκριμένη έγκριση στην Ευρωπαϊκή Ένωση, το nivolumab έχει λάβει έγκριση σε πέντε χώρες, συμπεριλαμβανομένων των Ηνωμένων Πολιτειών και της Ιαπωνίας, για τη δεύτερης γραμμής θεραπεία ασθενών με ανεγχείρητο προχωρημένο, υποτροπιάζον ή μεταστατικό καρκίνωμα του οισοφάγου εκ πλακωδών κυττάρων. Η Bristol Myers Squibb εκφράζει τις ευχαριστίες της στους ασθενείς και τους ερευνητές που συμμετείχαν στην κλινική μελέτη για τη σημαντική συμβολή τους.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον ΚόσμοΑκολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube