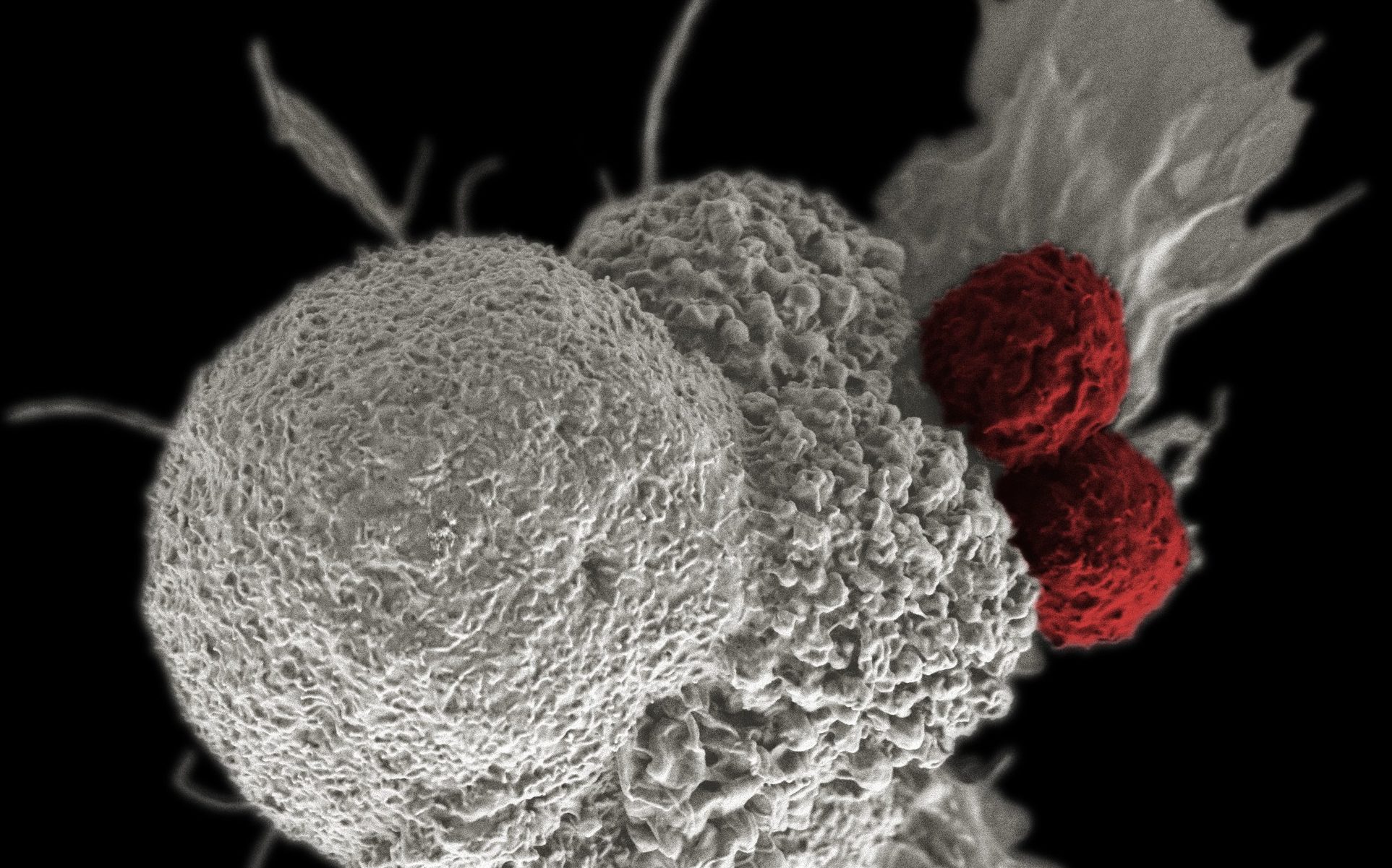
Ενθαρρυντικά τα αποτελέσματα για χορήγηση tisagenlecleucel σε παιδιά και νεαρούς ενήλικες με υποτροπιάζουσα/ανθεκτική Οξεία Λεμφοβλαστική Λευχαιμία (r/r ALL)
Mακροπρόθεσμες σταθερές υφέσεις με τη χορήγηση tisagenlecleucel σε παιδιά και νεαρούς ενήλικες με υποτροπιάζουσα/ανθεκτική Οξεία Λεμφοβλαστική Λευχαιμία (r/r ALL), παρουσιάζει η μελέτη ELIANA , σύμφωνα με την ανακοίνωση της Novartis.
- Η ανάλυση 75 ασθενών με διάμεση περίοδο παρακολούθησης μεγαλύτερη του ενός έτους κατέδειξε συνολικό ποσοστό ύφεσης 81%
• Η επιβίωση χωρίς συμβάματα και η συνολική επιβίωση στους έξι μήνες ήταν 73% και 90%, χωρίς να έχει επιτευχθεί η διάμεση διάρκεια ύφεσης
• Το tisagenlecleucel ανιχνεύθηκε σε ασθενείς μέχρι και 20 μήνες αργότερα, καταδεικνύοντας ότι τα τροποποιημένα κύτταρα παραμένουν στον οργανισμό μακροχρόνια
Η Novartis έχει δεσμευθεί να καταστήσει διαθέσιμο το tisagenlecleucel σε περισσότερους ασθενείς και έχει υποβάλει αίτηση η οποία αυτή την περίοδο είναι υπό εξέταση από τον Ευρωπαϊκό Οργανισμό Φαρμάκων (ΕΜΑ), για την υποτροπιάζουσα/ανθεκτική ΟΛΛ (r/r ALL) και τo υποτροπιάζον/ανθεκτικό διάχυτο από Β μεγάλα κύτταρα λέμφωμα (r/r DLBCL), με βάση το παγκόσμιο πρόγραμμα κλινικών δοκιμών της Novartis, στο οποίο περιλαμβάνεται και η μελέτη ELIANA
Τα νέα δεδομένα περιλαμβάνουν στοιχεία παρακολούθησης και αποτελεσματικότητας μεγαλύτερης διάρκειας σε 75 ασθενείς που έλαβαν έγχυση, την ανάλυση επέκτασης και παραμονής (persistence) του tisagenlecleucel, καθώς και δεδομένα μακρόχρονης ασφάλειας. Το tisagenlecleucel έγινε η πρώτη θεραπεία Τ λεμφοκυττάρων με χιμαιρικούς αντιγονικούς υποδοχείς (CAR-T) που έλαβε έγκριση τον Αύγουστο 2017, όταν εγκρίθηκε από τον Οργανισμό Τροφίμων και Φαρμάκων των Ηνωμένων Πολιτειών (FDA) για τη θεραπεία ασθενών ηλικίας έως 25 ετών με πρόδρομο Β ΟΛΛ που είναι ανθεκτική ή βρίσκεται σε δεύτερη ή μεταγενέστερη υποτροπή, με βάση προηγούμενα αποτελέσματα της μελέτης ELIANA, η οποία διεξήχθη σε συνεργασία με το Πανεπιστήμιο της Πενσυλβάνια (Penn) και το Παιδιατρικό Νοσοκομείο της Φιλαδέλφειας (Children’s Hospital of Philadelphia -CHOP).
Στην ανάλυση των δεδομένων 75 ασθενών που έλαβαν έγχυση με στοιχεία παρακολούθησης τριών ή περισσότερων μηνών, το tisagenlecleucel κατέδειξε συνολικό ποσοστό ύφεσης 81% (διάστημα εμπιστοσύνης 95%: 71% – 89%). Ποσοστό 60% των ασθενών πέτυχαν πλήρη ύφεση (CR) και ποσοστό 21% των ασθενών πέτυχαν πλήρη ύφεση (CR) με ατελή ανάκαμψη (CRi), χωρίς να ανιχνεύεται ελάχιστη υπολειπόμενη νόσος (MRD) σε κανέναν από τους ασθενείς που παρουσίασαν ανταπόκριση (95% [58/61] έως την 28η ημέρα). Η διάμεση παρακολούθηση ήταν 13,1 μήνες.
«Το tisagenlecleucel, η πρώτη εγκεκριμένη από τον Οργανισμό Τροφίμων και Φαρμάκων των Ηνωμένων Πολιτειών CAR-T κυτταρική θεραπεία (Τ κύτταρα με χιμαιρικούς αντιγονικούς υποδοχείς), έχει δείξει ότι είναι εν δυνάμει μια οριστική θεραπεία, και παρέχει έγκαιρες, βαθιές και σταθερές υφέσεις για παιδιά και νεαρούς ενήλικες με υποτροπιάζουσα ή ανθεκτική ΟΛΛ», ανέφερε ο Samit Hirawat, MD, Επικεφαλής της Novartis Oncology Global Drug Development. «Τα δεδομένα αυτά αποτελούν μαρτυρία της δέσμευσης της Novartis για συνεχή έρευνα στον τομέα της θεραπείας CAR-T κυττάρων, προκειμένου να διατεθεί η θεραπεία αυτή σε όσο το δυνατόν περισσότερους ασθενείς».
Μεταξύ των ασθενών που πέτυχαν πλήρη ύφεση (CR) ή πλήρη ύφεση με ατελή ανάκαμψη (CRi), η διάμεση διάρκεια ανταπόκρισης δεν επετεύχθη. Οι υφέσεις ήταν διαρκείας με 80% επιβίωση χωρίς υποτροπή στους έξι μήνες.
Το ποσοστό επιβίωσης χωρίς συμβάματα ήταν 73% στους έξι μήνες (διάστημα εμπιστοσύνης 95%: 60%-82%) και 50% στους 12 μήνες (διάστημα εμπιστοσύνης 95%: 35%-64%), ενώ η διάμεση επιβίωση χωρίς συμβάματα δεν επετεύχθη. Η συνολική επιβίωση στους 75 ασθενείς που έλαβαν έγχυση ήταν 90% (διάστημα εμπιστοσύνης 95%: 81%-95%) στους έξι μήνες και 76% (διάστημα εμπιστοσύνης 95%: 63%-86%) στους 12 μήνες. Το isagenlecleucel ανιχνεύθηκε σε ασθενείς έως και 20 μήνες αργότερα.
Η διάμεση παραμονή (persistence) του tisagenlecleucel ήταν 168 ημέρες (εύρος: 20-617, n=60 ασθενείς με πλήρη ύφεση/πλήρη ύφεση με ατελή ανάκαμψη) την ημερομηνία αποκοπής των δεδομένων (data cutoff). Όλοι οι ασθενείς με ανταπόκριση παρουσίασαν απλασία Β κυττάρων (χαμηλός αριθμός Β κυττάρων ή παντελής απουσία Β κυττάρων), μια επίδραση εντός στόχου της αγωγής με tisagenlecleucel, και οι περισσότεροι έλαβαν υποκατάσταση με ανοσοσφαιρίνη ανάλογα με την τοπική πρακτική.
Οι ασθενείς που ήταν δυνατό να αξιολογηθούν, με ανταπόκριση κατά την 28η ημέρα, είχαν διάμεσο χρόνο μέχρι τη μέγιστη επέκταση των κυττάρων 10 ημέρες (5,7-28 ημέρες, n=60), ενώ έξι ασθενείς χωρίς ανταπόκριση είχαν διάμεσο χρόνο μέχρι τη μέγιστη επέκταση 20 ημέρες (13-63 ημέρες).
Το tisagenlecleucel χρησιμοποιεί την περιοχή συνδιέγερσης 4-1BB στον χιμαιρικό αντιγονικό υποδοχέα, που έχει αποδειχθεί ότι ενισχύει την πρώιμη κυτταρική επέκταση και την μακρόχρονη παραμονή των CAR-T κυττάρων.
«Εξακολουθούν να μας ενθαρρύνουν τα αποτελέσματα που έχουν επιτευχθεί με το tisagenlecleucel σε έναν πληθυσμό ασθενών που στο παρελθόν είχε περιορισμένες θεραπευτικές επιλογές, ενώ τώρα έχει τη δυνατότητα μεγάλων σε διάρκεια υφέσεων, που μεταφράζονται σε πιο μακρόχρονη επιβίωση», ανέφερε η επικεφαλής συγγραφέας της μελέτης Shannon L. Maude, MD, PhD, Επίκουρη Καθηγήτρια Παιδιατρικής στο Παιδιατρικό Νοσοκομείο της Φιλαδέλφειας και στην Ιατρική Σχολή Perelman στο Πανεπιστήμιο της Πενσυλβάνια.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον ΚόσμοΑκολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube