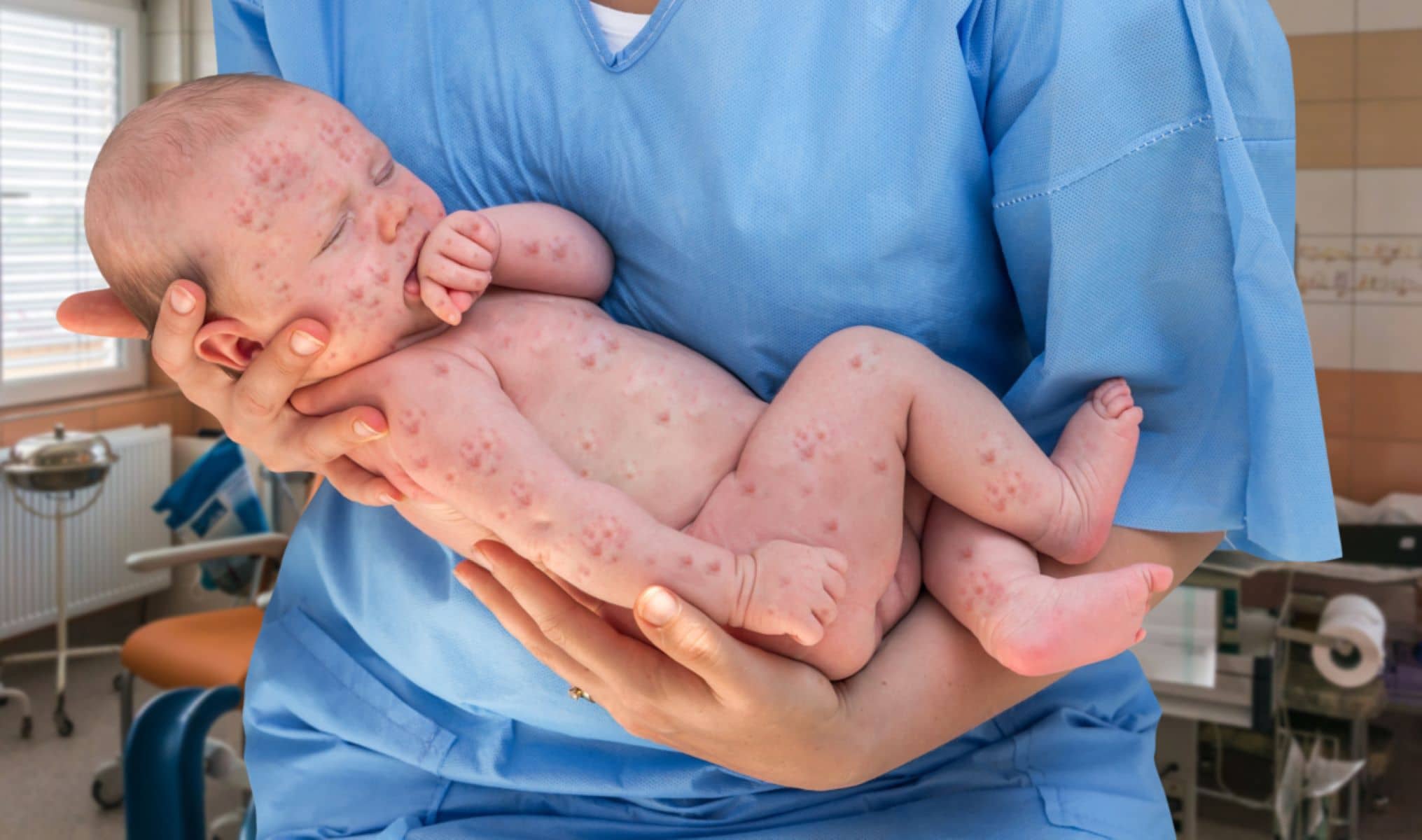
Εγκρίθηκε ο πρώτος βιολογικός παράγοντας για θεραπεία της ατοπικής δερματίτιδας για παιδιά 6 έως 11 ετών.
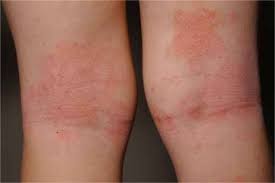
Η ατοπική δερματίτιδα είναι μία χρόνια φλεγμονώδης νόσος του δέρματος που ενδέχεται να καταστεί εξουθενωτική και η σοβαρή μορφή της νόσου μπορεί να επηρεάσει σημαντικά πολλές πτυχές της ζωής τόσο των παιδιών, όσο και των οικογενειών τους.
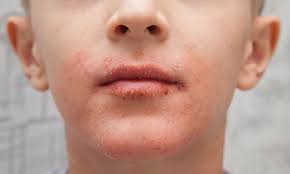
Η Ευρωπαϊκή Επιτροπή επέκτεινε την άδεια κυκλοφορίας για το dupilumab στην Ευρωπαϊκή Ένωση (ΕΕ) ώστε να περιλαμβάνει παιδιά ηλικίας 6 έως 11 ετών με σοβαρή ατοπική δερματίτιδα, τα οποία κρίνονται κατάλληλοι υποψήφιοι για λήψη συστηματικής θεραπείας. Το dupilumab αποτελεί τη μοναδική συστηματική θεραπεία που είναι εγκεκριμένη στην ΕΕ για την θεραπεία των συγκεκριμένων ασθενών.«Ως γονέας ενός παιδιού με ατοπική δερματίτιδα και ως κάποια που εργάζεται με οικογένειες που επηρεάζονται από αυτή την πάθηση σε καθημερινή βάση, έχω διαπιστώσει προσωπικά το τεράστιο σωματικό και ψυχικό φορτίο της συγκεκριμένης νόσου, καθώς και τις επιπτώσεις που μπορεί να έχει σε ολόκληρη την οικογένεια», δήλωσε η Korey Capozza, MPH, Ιδρύτρια και Εκτελεστική Διευθύντρια της οργάνωσης Global Parents for Eczema Research (GPER). «Τα μικρά παιδιά με σοβαρή ατοπική δερματίτιδα έχουν σήμερα στη διάθεσή τους ελάχιστες θεραπευτικές επιλογές και σημαντικές ακάλυπτες ιατρικές ανάγκες. Χαιρετίζουμε την ανάπτυξη νέων φαρμάκων για αυτό τον υποεξυπηρετούμενο πληθυσμό ασθενών».
«Η έγκριση του dupilumab για παιδιά στην Ευρώπη αποτελεί ένα ακόμα σημαντικό ορόσημο για τους ασθενείς με ατοπική δερματίτιδα και τις οικογένειές τους, διευρύνοντας τη διαθεσιμότητα ενός, πρώτου στην κατηγορία του, φαρμάκου που παρέχει μία αποδεδειγμένα ασφαλή και αποτελεσματική θεραπεία για τη συγκεκριμένη εξουθενωτική νόσο του δέρματος», δήλωσε ο John Reed, M.D., Ph.D., Global Head of Research and Development της Sanofi. «Η ικανότητα του dupilumab να προσφέρει σημαντικά υψηλή κάθαρση του δέρματος και κλινικά σημαντική μείωση του επίμονου κνησμού ανταποκρίνεται σε σημαντικές ακάλυπτες ανάγκες στα συγκεκριμένα παιδιά. Επιπλέον, συνεχίζουμε να διερευνούμε τις δυνατότητες του dupilumab σε νεότερες ηλικιακές ομάδες και σε μια ποικιλία νόσων που χαρακτηρίζονται από φλεγμονή τύπου 2». Το dupilumab είναι ένα πλήρως ανθρώπινο μονοκλωνικό αντίσωμα που αναστέλλει τη σηματοδότηση των πρωτεϊνών ιντερλευκίνη-4 (IL-4) και ιντερλευκίνη-13 (IL-13). Δεδομένα από κλινικές μελέτες του dupilumab έχουν δείξει ότι η ιντερλευκίνη-4 και η ιντερλευκίνη-13 είναι βασικοί παράγοντες της φλεγμονής τύπου 2, η οποία παίζει σημαντικό ρόλο στην ατοπική δερματίτιδα, στο άσθμα και στη χρόνια ρινοκολπίτιδα με ρινικούς πολύποδες.
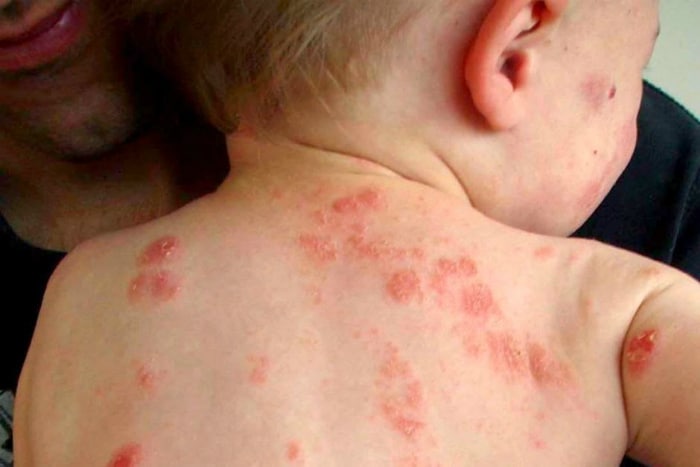
«Η συγκεκριμένη έγκριση για το dupilumab στην ΕΕ αντιπροσωπεύει μια σημαντική εξέλιξη για τα παιδιά με σοβαρή ατοπική δερματίτιδα και τις οικογένειές τους, που περνούν αμέτρητες μέρες και νύχτες ασχολούμενοι με τη νόσο του παιδιού έχοντας στη διάθεσή τους ελάχιστες θεραπευτικές επιλογές που συμβάλλουν στην ανακούφιση των εξουθενωτικών συμπτωμάτων», δήλωσε ο George D. Yancopoulos, M.D., Ph.D., President and Chief Scientific Officer της Regeneron. «Το dupilumab είναι μια καινοτόμος θεραπεία που αντιμετωπίζει μία κύρια αιτία της ατοπικής δερματίτιδας στοχεύοντας ειδικά την υποκείμενη φλεγμονή τύπου 2 της νόσου. Το dupilumab έχει ήδη χρησιμοποιηθεί από εκατοντάδες χιλιάδες ασθενείς σε ολόκληρο τον κόσμο, στους οποίους περιλαμβάνονται ασθενείς με ατοπική δερματίτιδα αλλά και άλλες νόσους που χαρακτηρίζονται από φλεγμονή τύπου 2, όπως το άσθμα, καθώς και ενήλικες με χρόνια ρινοκολπίτιδα με ρινικούς πολύποδες. Εκφράζουμε την ικανοποίησή μας που προσφέρουμε αυτό το καινοτόμο φάρμακο σε ακόμη νεότερους ασθενείς στην ΕΕ οι οποίοι έχουν ανάγκη νέες επιλογές πέρα από τα στεροειδή ή τα ανοσοκατασταλτικά».
Σε παιδιά ηλικίας 6-11 ετών με σωματικό βάρος 15 έως <60 kg, το dupilumab 300 mg χορηγείται ως υποδόρια ένεση κάθε 4η εβδομάδα μετά από τη δόση έναρξης που χορηγείται σε δύο ενέσεις σε απόσταση 14ων ημερών. Για τους ασθενείς με σωματικό βάρος >60 kg, το dupilumab 300 mg χορηγείται κάθε 2η εβδομάδα μετά από τη δόση έναρξης που χορηγείται την ίδια ημέρα. Η δόση είναι δυνατό να αυξηθεί σε 200 mg κάθε 2η εβδομάδα σε ασθενείς με σωματικό βάρος 15 έως <60 kg με βάση την αξιολόγηση του θεράποντος ιατρού.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον Κόσμο
Ακολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube