Καχεξία λόγω Kαρκίνου: Ερευνητές από το Τμήμα Μοριακής Βιολογίας και Γενετικής του Πανεπιστημίου Koc στην Τουρκία και τον Πόλο Ενδοκρινολογίας, Διαβητολογίας και Διατροφής του Ινστιτούτου Πειραματικής και Κλινικής Έρευνας του Καθολικού Πανεπιστημίου της Λουβέν στο Βέλγιο συνεργάστηκαν για να διερευνήσουν τους μηχανισμούς που κρύβονται πίσω από ένα σύνδρομο εξάντλησης που σχετίζεται με την καχεξία λόγω καρκίνου. Η εργασία “Η σηματοδότηση EDA2R-NIK προάγει τη μυϊκή ατροφία που συνδέεται με την καχεξία λόγω καρκίνου”,”EDA2R-NIK signalling promotes muscle atrophy linked to cancer cachexia”, που δημοσιεύθηκε στο Nature, περιγράφει λεπτομερώς την ανακάλυψη του τρόπου με τον οποίο μια εναλλακτική ωρίμανση της εκτοδυσπλασίας Α (EDA) οδηγεί σε μια οδό σηματοδότησης στην παθολογία της καχεξίας. Ένα άρθρο του News & Views που δημοσιεύθηκε στο ίδιο περιοδικό περιγράφει τα ευρήματα της μελέτης. Η EDA, ένας τύπος κυτταροκίνης, ανήκει στην υπεροικογένεια του παράγοντα νέκρωσης όγκων (TNF) των σηματοδοτικών πρωτεϊνών που παράγονται από τα λευκά αιμοσφαίρια για να κάνουν τη δουλειά του ανοσοποιητικού συστήματος. Οι ερευνητές ανακάλυψαν ότι ένα εναλλακτικό μάτισμα της EDA, το αγγελιοφόρο RNA EDA2R, ήταν εμπλουτισμένο στους σκελετικούς μυϊκούς ιστούς των ποντικών με το σύνδρομο της καχεξίας που προκαλεί εξάντληση.
Σύνδρομο σπατάλης
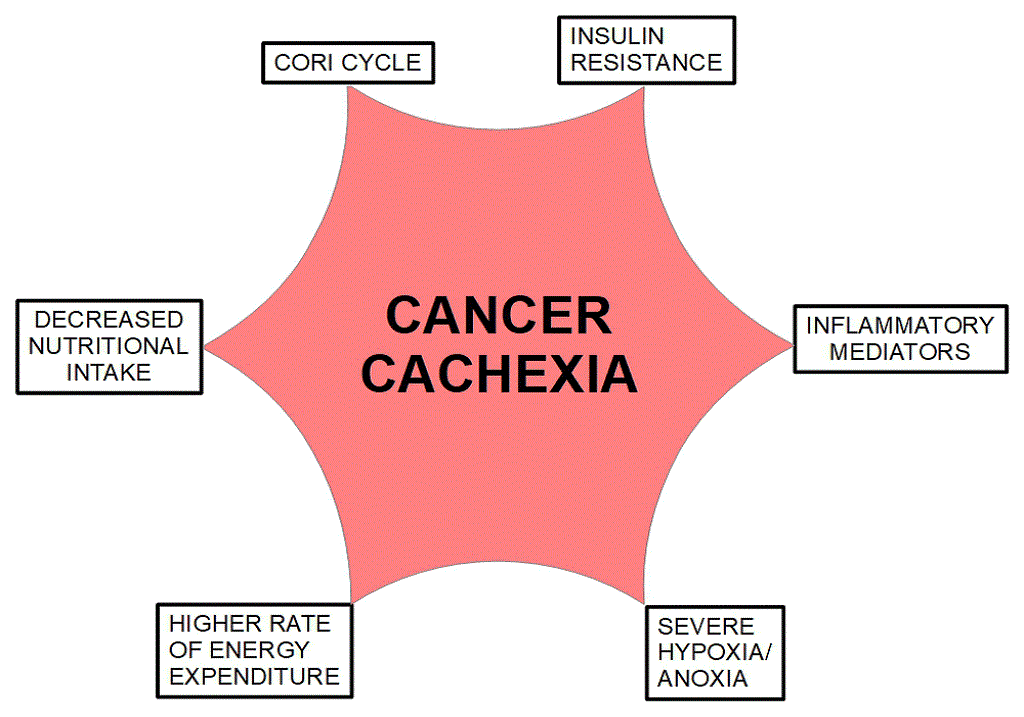
Η καχεξία εμφανίζεται συχνότερα σε προχωρημένο καρκίνο του παγκρέατος και του πνεύμονα και συχνά σε καρκίνο του παχέος εντέρου, των ωοθηκών και του ήπατος. Oρίζεται ως απώλεια 5% ή περισσότερο του σωματικού βάρους κατά τους προηγούμενους έξι μήνες, η καχεξία μπορεί επίσης να προκαλέσει κόπωση και μειωμένη δύναμη. Ο ορισμός από μόνος του είναι ένα πρόχειρο μέτρο μιας πιο σύνθετης φυσιολογικής κατάστασης που μπορεί να διαφύγει στη διάγνωση, καθώς επικαλύπτει παρόμοιες επιδράσεις που μπορεί να έχουν οι θεραπείες του καρκίνου. Η σωματική ατροφία με την καχεξία μπορεί να επιταχυνθεί καθώς ο ασθενής μπορεί να μην είναι σε θέση να εκτελέσει εργασίες ρουτίνας όπως το μπάνιο, τα ψώνια ή η σίτιση, είτε λόγω έλλειψης σωματικής ενέργειας είτε λόγω απουσίας όρεξης. Τα προβλήματα ψυχικής υγείας μπορεί να ακολουθήσουν γρήγορα. Επιπλέον, η πτώση από την καχεξία θεωρείται άμεσα αιτιώδης για σχεδόν το ένα τρίτο των θανάτων από καρκίνο, όταν εμφανίζεται καρδιακή ή αναπνευστική ανεπάρκεια λόγω μυϊκής απώλειας. Χωρίς γνωστό μηχανισμό, ακόμη και η διάγνωση μπορεί να έχει περιορισμένη χρήση σε κλινικές ρυθμίσεις χωρίς αποτελεσματικές θεραπείες και σαφή πορεία δράσης.
Ενδιαφέρουσα συσχέτιση
Μέσω αναζητήσεων γονιδιακής έκφρασης σε βιοψίες μυών, οι ερευνητές εντόπισαν αυξημένο mRNA EDA2R σε ασθενείς με καχεκτικούς καρκίνους (καρκίνο του πνεύμονα, του γαστρεντερικού, του παγκρέατος και του παχέος εντέρου) σε σύγκριση με καρκινοπαθείς χωρίς καχεξία και μάρτυρες χωρίς καρκίνο. Επιπλέον, η ομάδα διαπίστωσε ότι οι ασθενείς που πάσχουν από μειωμένη μυϊκή μάζα και λειτουργία με μυϊκή δυστροφία Duchenne (DMD) και φατνιακή μυϊκή δυστροφία (FSHD) είχαν επίσης σημαντικά αυξημένη μεταγραφή EDA2R. Με τη συσχέτιση του μονοπατιού EDA-A2-EDA2R που ανιχνεύθηκε, οι ερευνητές συνέχισαν την έρευνα περαιτέρω.
Ανακάλυψη μηχανισμών
Ξεκινώντας με καλλιέργειες ιστών και προχωρώντας σε ένα μοντέλο ποντικού, η ομάδα διαπίστωσε επανειλημμένα ότι τα αυξημένα επίπεδα πρωτεΐνης EDA-A2 είχαν επιβλαβή αποτελέσματα. Παρατήρησαν μείωση του μεγέθους των κυττάρων στις καλλιέργειες ιστών και τα πειράματα σε ποντίκια in vivo έδειξαν βαθύ εκφυλισμό των μυών. Τα πειράματα αποκάλυψαν επίσης μεταγενέστερες επιδράσεις της EDA-A2 μετά την αλληλεπίδραση με τον υποδοχέα της. Η κινάση που επάγει τον NFĸB (NIK), ένας βασικός ρυθμιστής των μεταγραφικών παραγόντων που ελέγχουν την έκφραση σημαντικού αριθμού γονιδίων, τίθεται σε κίνηση για την ενεργοποίηση γονιδίων που μεταγράφουν ένζυμα που μπορούν να διασπάσουν τους μυϊκούς ιστούς. Ανάντη της έκφρασης του υποδοχέα EDA2R, οι ερευνητές εντόπισαν την επαγόμενη από τον όγκο ογκοστατίνη Μ (OSM) ως βασικό ρυθμιστή ανόδου. Η εξάντληση του αγγελιοφόρου RNA της OSM στους μύες τους προστάτευσε από τη σπατάλη και την ατροφία. Τα αποτελέσματα της μελέτης υποδηλώνουν ότι η σηματοδότηση OSM-OSMR δρα παράλληλα με το μονοπάτι EDA2R-NIK και ενισχύει τη μυϊκή ατροφία και την ανοδική ρύθμιση του EDA2R. Η διαγραφή είτε του EDA2R είτε του NIK σε ποντίκια ήταν επαρκής για να προσδώσει αντίσταση έναντι της μυϊκής φθοράς που προκαλείται από όγκο. Οι συγγραφείς προτείνουν ότι η στόχευση του μονοπατιού OSM-OSMR θα μπορούσε επίσης να αποτελέσει θεραπευτικό στόχο υψηλής αξίας. Όπως συμβαίνει με το τέλος κάθε καλής μελέτης, απαιτείται περισσότερη έρευνα. Τα επόμενα βήματα μπορεί να είναι ο προσδιορισμός των στόχων που κατέχουν τις καλύτερες αναλογίες κινδύνου-οφέλους και η προώθηση της κατανόησης των αιτιωδών σχέσεων προς μια κλινική παρέμβαση.